Diagnose
Körperlänge: 3–15 mm, maximal 25 mm.
Stechmücken sind von allen anderen Zweiflüglern durch einen Stechrüssel, der länger ist als der Thorax sowie Schuppen auf Kopf, Thorax (inkl. Flügel und Beine) und Abdomen unterscheidbar.
Kopf: Weibchen haben lange, vielgliedrige Fühler mit wenigen langen Borsten an der Basis jedes Geißelgliedes. Fühlerglieder der Männchen auffallend lang und dicht behaart, das letzte Glied trägt wenige lange Borsten, wie beim Weibchen.
Thorax: Klauen der Vorder- und Hinterbeine bei den Männchen vergrößert.
Merkmale
Eine Terminologie für die Morphologie der Eier, Larven, Puppen und Adulten der Stechmücken wurde in der Publikationsreihe "A Mosquito Taxonomic Glossary" von Knight (1970, 1971), Knight & Laffoon (1970 a–c, 1971 a–b), Laffoon & Knight (1971, 1973), Harbach & Knight (1977 a–d, 1978 a–c) zusammengestellt. Diese Publikationen wurden von Harbach & Knight (1980) in einem Buch zusammengefasst, dem zwei Jahre später Korrekturen folgten (Harbach & Knight 1982). Eine umfangreich revidierte und aktualisierte Fassung findet sich im Internet bei Harbach (2013–2020).
Die häufigsten Schuppenformen sind „gegabelt“ (Aedes communis), ruderblattartig (Aedes communis, Aedes cantans) und sichelförmig (Scutum, Culiseta annulata; Scutum und Scheitel Aedes communis).
Vorkommen und Diversität
Weltweit gibt es 3.570 wissenschaftlich beschriebene Stechmückenarten. Es wird geschätzt, dass diese etwa 50% der tatsächlichen Diversität ausmachen. Viele Arten können noch mithilfe traditioneller, morphologischer Methoden entdeckt und beschrieben werden, aber es gibt auch zahlreiche Artkomplexe, die zunächst wohl nur mit molekulargenetischen Methoden sicher identifiziert werden können. Die Artenvielfalt der Stechmücken nimmt zum Äquator zu. Verschleppung durch den Menschen und Klimawandel führen zur Etablierung und Ausbreitung von Arten in Gebieten, in denen sie zuvor nicht vorkamen (Wilkerson et al. 2021).
In Deutschland sind 53 Arten etabliert (Werner et al. 2020; Kuhlisch 2022).
Stammesgeschichte
Die ältesten bekannten Stechmücken-Fossilien sind Burmaculex antiquus Borkent & Grimaldi, 2004 und Priscoculex burmanicus Poinar, Zavortink & Brown 2019 aus burmesischem Bernstein aus der Kreidezeit von vor 90 – 100 Mio. Jahren.
Phylogenetische Analysen liegen u.a. von Harbach & Kitching (1998), Reinert et al. (2004, 2006, 2009), Harbach et al. (2012) sowie eine Überblicksarbeit zur Taxonomie, Klassifikation und Phylogenie von Harbach (2007) vor. Danach sind unter den rezenten Stechmücken zwei Monophyla gestützt, die Anophelinae und die Culicinae. Eine Analyse mitochondrialer Genome von 86 Arten, 15 Gattungen und 7 Tribus der Stechmücken bestätigt dieses Verwandtschaftsverhältnis sowie die Monophylie der meisten Gattungen und Tribus innerhalb der Culicidae (da Silva et al. 2020). Die Analyse dieser molekularen Daten weist zudem auf einen Ursprung der Stechmücken bereits im Jura hin (da Silva et al. 2020).
Lebensweise
Die Adulten sind tag-, dämmerungs- oder nachtaktiv. Männchen und Weibchen saugen Nektar, um an Kohlenhydrate zu gelangen. Bei den Männchen beeinflusst diese Nahrungsaufnahme maßgeblich den Überlebens- und Paarungserfolg (Barredo & DeGennaro 2020). Die Weibchen der meisten Arten saugen Blut an Wirbeltieren. Sie finden ihre Wirte, indem sie deren ausgeatmetes Kohlendioxid, organische Gerüche der Haut, visuelle Eigenschaften sowie die Infrarotstrahlung, die von den Wirten ausgeht, wahrnehmen (Smallegange et al. 2005; Dekker & Ring 2011; Chandel et al. 2024). Die Blutmahlzeit wird für die Eireifung benötigt. Einige außereuropäisch verbreitete Arten sind keine Blutsauger sondern ernähren sich von Pflanzensäften (Toxorhynchites) oder den Futtersäften von Ameisen (Malaya). Die Paarung wird meistens im Flug vollzogen. Die Weibchen legen ihre Eier meist nach einer Blutmahlzeit in feuchte Substrate, die später überschwemmt werden, an Treibgut oder Substrat direkt oberhalb der Wasserlinie oder direkt ins Wasser. Bei letzteren enthalten die Eier Luftkammern, weshalb sie einzeln (Anopheles) oder im Gelege (Culex) an der Oberfläche schwimmen ("Ei-Schiffchen") (Ziegler 2003).
Die Larven leben aquatisch in oberflächennahen Wasserschichten und tauchen bei Störung mit pendelnden Bewegungen abwärts. Sie nehmen den Sauerstoff zum Atmen aus der Atmosphäre über das letzte abdominale Stigmenpaar oder ein Atemrohr auf. Sie ernähren sich filtrierend von Detritus und Plankton, Arten der in Deutschland nicht vorkommenden Gattung Toxorhynchites sind räuberisch. Die Puppen besitzen zwei prothorakale Atemhörner (Ziegler 2003).
In ihren aquatischen Lebensräumen haben die Larven der Stechmücken natürliche Gegenspieler. Beispielsweise wurde experimentell gezeigt, dass die Ruderfußkrebse (Copepoda) Megacyclops viridis und M. gigas effiziente Gegenspieler der Larven der Japanischen Buschmücke (Aedes japonicus) (Früh et al. 2019) sowie die räuberischen Schwimmkäfer (Dytiscidae) Agabus bipustulatus, gefolgt von Agabus nebulosus, Laccophilus minutus und Hygrotus impressopunctatus effiziente Gegenspieler der Larven der Asiatischen Tigermücke (Aedes albopictus) in kleinen Wasserbehältern sind (Vanslembrouck et al. 2024).
Medizinische Bedeutung
Stechmücken werden oft als ‘die für die Menschheit tödlichste Tierart’ dargestellt. Tatsächlich töten Stechmücken selbst keine Menschen, aber die Weibchen können beim Blutsaugen Erreger von Krankheiten (Pathogene) des Menschen übertragen und von den weltweit über 3.500 bekannten Stechmückenarten sind ein paar Dutzend Arten potenzielle Überträger (Vektoren) von Krankheitserregern. So können Arten der Gattung Anopheles Erreger der Malaria (Plasmodium spp.), Arten der Gattungen Aedes und Culex des West-Nil-Virus sowie die Asiatische Tigermücke (Aedes albopictus) humanpathogene Flaviviren wie Gelbfieber-, Dengue-, West-Nil- und Zika-Virus übertragen (Schaffner & Mathis 2014). Allein an Malaria starben in den Jahren 1980–2010 jährlich zwischen 995.000 und 1,8 Mio. Menschen (Murray et al. 2012) und allein 2020 gab es weltweit 241 Mio. Malariafälle (WHO 2021).
In den zurückliegenden Jahrzehnten spielten die durch diese Erreger in Deutschland verursachten Krankheiten vor allem dann eine Rolle, wenn sie von Reisenden aus anderen Gebieten mitgebracht wurden. Durch den Klimawandel ist es aber möglich, dass in wärmeren, südlichen Regionen vorkommende Mückenarten, die als Überträger von Krankheitserregern in Frage kommen, sich nach Norden ausbreiten oder verschleppt und hier indigen werden sowie die Krankheitserreger selbst sich in Deutschland vorkommenden Mückenarten entwickeln können (Maier et al. 2003). Einen Überblick über das Vorkommen einheimischer und die Ausbreitung fremdländischer Mückenarten in Deutschland, die als Überträger von Krankheitserregern des Menschen in Frage kommen, als auch über Auftreten und Einschleppung der Krankheitserreger selbst geben Maier et al. (2003).
Ob eine individuelle Stechmücke, die zu einer Art gehört, welche potenziell einen Krankheitserreger übertragen kann, diesen auch tatsächlich überträgt, hängt u.a. von der Prävalenz des Erregers in der Wirtspopulation und dem Vorhandensein genetischer Resistenzfaktoren in den Mücken ab. Zudem beeinflussen die Häufigkeit einer Stechmückenart bedingt durch den Witterungsverlauf (Temperatur und Regen) und die relative Häufigkeit verschiedener Mückenarten zueinander das konkrete Krankheitsgeschehen in einer Region (Gildenhardt et al. 2019).
Der Infektion durch stechmückenübertragbare Krankheiten kann durch das Tragen langer, mückendichter Kleidung, die Verwendung von Repellents auf nicht abgedeckten Hautpartien und die Nutzung von Moskitonetzen während der Nacht vorgebeugt werden. Ferner kann ein Eindringen von Mücken in Häuser durch das Anbringen von Gaze vor den Fenstern unterbunden werden.
Besonderheiten
In der Aquaristik werden die Larven der Stechmücken regelmäßig als Fischfutter verwendet. Aufgrund ihrer Färbung sowie zur Unterscheidung von den Larven der Chaoboridae und Chironomidae, die in der Aquaristik ebenfalls Verwendung finden, werden sie "Schwarze Mückenlarven" genannt.
Bestimmung der Arten
Die Bestimmung der Arten erfordert in der Regel ein Stereomikroskop. Die überwiegende Zahl der aus Deutschland bekannten Arten ist anhand morphologischer Merkmale bestimmbar. Männchen werden nach dem Bau des Kopulationsapparates unterschieden. Schuppen und Borsten auf Kopf und Thorax bieten wichtige Merkmale zur Unterscheidung der Weibchen. Einige Arten können nur durch das Studium großer Serien identifiziert werden, unter Einbeziehung zytologischer und biochemischer Untersuchungsmethoden. Zur molekulargenetischen Bestimmung werden vor allem Cox I und ITS2 genutzt (Wilkerson et al. 2021).
Ausführliche Beschreibungen der Arten finden sich bei Mohrig (1969) und Becker et al. (2003). Ein weiterer Bestimmungsschlüssel findet sich bei Zittra (2012). Für Nichtfachleute gibt es ein einfaches Instrument zur Unterscheidung von invasiven und einheimischen Mückenarten bei Briet et al. (2021).
Literatur
- Barredo, E. & M. DeGennaro 2020: Not Just from Blood: Mosquito Nutrient Acquisition from Nectar Sources. – Trends in Parasitology 36 (5): 473-484.
- Becker N., D. Petric , M. Zgomba, C. Boase, C. Dahl, M. Madon &. A. Kaiser 2010 (2. Aufl.): Mosquitoes and their control. – Springer Heidelberg Dordrecht London New York, New York, 577 S.
- Borkent, A. & D. A. Grimaldi 2004: The Earliest Fossil Mosquito (Diptera: Culicidae), in Mid-Cretaceous Burmese Amber. – Annals of the Entomological Society of America 97: 882–888.
- Briët, O., A. Lindström, D. Eklöf, N. Van Hul, M. Braks, D. Petrić, F. Schaffner & W. Van Bortel 2021: 'Reverse' identification key for mosquito species. – European Centre for Disease Prevention and Control (ECDC) & European Food Safety Agency. 21 S.
- Britz, L. 1955: Über die Stechmücken-Fauna (Dipt., Culicidae) des Stadtkreises Leipzig. – Zeitschrift für angewandte Zoologie 42: 61–79.
- Britz, L. 1983: Informationen über Culex torrentinum und C. territans (Diptera, Culicidae). – Angewandte Parasitologie 24: 216–223.
- Britz, L. 1985: Zur Klassifikation der Brutplätze von Stechmücken (Diptera, Culicidae). – Angewandte Parasitologie 26: 157–164.
- Britz, L. 2010: Aus der Geschichte. 40 Jahre Medizinische Arthropodenkunde im Raum Leipzig (1950–1990). Eine Bibliographie. – Entomologische Nachrichten und Berichte 54 (1): 76–77.
- Britz, L. 2010: Aus der Geschichte. Stechmückenforschung in Leipzig (Diptera, Culicidae). – Entomologische Nachrichten und Berichte 54 (3–4): 266–268.
- Chandel, A., N. A. DeBeaubien, A. Ganguly, G. T. Meyerhof, A. A. Krumholz, J. Liu, V. L. Salgado & C. Montell 2024: Thermal infrared directs host-seeking behaviour in Aedes aegypti mosquitoes. – Nature .
- da Silva, A. F., L. C. Machado, M. B. de Paula, C. J. da Silva Pessoa Vieira, R. Vieira de Morais Bronzoni, M. A. Varjal de Melo Santos & G. Luz Wallau 2020: Culicidae evolutionary history focusing on the Culicinae subfamily based on mitochondrial phylogenomics. – Scietific Reports 10: 18823.
- Dahl, C. I., A. Kaiser & N. Becker 1999: Culicidae. S. 51–52. – In: H. Schumann, R. Bährmann & A. Stark, Checkliste der Dipteren Deutschlands. – Studia Dipterologica, Suppl. 2.
- Dahl, C. & G. B. White 1978: Culicidae. S. 390–395. – In: J. Illies, Limnofauna Europaea. Stuttgart.
- Dekker, T. & T. Ring 2011: Cardé; Moment-to-moment flight manoeuvres of the female yellow fever mosquito (Aedes aegypti L.) in response to plumes of carbon dioxide and human skin odour. – Journal of Experimental Biology 214 (20): 3480–3494.
- Früh, L., H. Kampen, G. A. Schaub & D. Werner 2019: Predation on the invasive mosquito Aedes japonicus (Diptera: Culicidae) by native copepod species in Germany. – Journal of Vector Ecology 44: 241–247.
- Gildenhard, M., E. K. Rono, A. Diarra, A. Boissière, P. Bascunan, P. Carrillo-Bustamante, D. Camara, H. Krüger, M. Mariko, R. Mariko, P. Mireji, S. E. Nsango, J. Pompon, Y. Reis, M. K. Rono, P. B. Seda, J. Thailayil, A. Traorè, C. V. Yapto, P. Awono-Ambene, R. K. Dabiré, A. Diabaté, D. Masiga, F. Catteruccia, I. Morlais, M. Diallo, D. Sangare & E. A. Levashina 2019: Mosquito microevolution drives Plasmodium falciparum dynamics. – Nature Microbiology 4: 941–947.
- Hall, M. & D. Tamïr 2021: Mosquitopia – The Place of Pests in a Healthy World. – Routledge, Abingdon & New York. XXI+289 S.
- Harbach, R. E. 2007: The Culicidae (Diptera): a review of taxonomy, classification and phylogeny. – Zootaxa 1668, 591–638.
- Harbach, R. E. & I. J. Kitching 1998: Phylogeny and classification of the Culicidae (Diptera). – Systematic Entomology 23: 327–370.
- Harbach, R. E., I. J. Kitching, C. L. Culverwell, J. Dubois & Y.-M. Linton 2012: Phylogeny of mosquitoes of tribe Culicini (Diptera: Culicidae) based on morphological diversity: phylogeny of Culicini. – Zoologica Scripta 41: 499–514.
- Harbach, R. E. & K. L. Knight 1977 a: A Mosquito Taxonomic Glossary. X. The Larval Mandible. – Mosquito Systematics Newsletter 9 (1): 25–57.
- Harbach, R. E. & K. L. Knight 1977 b: A Mosquito Taxonomic Glossary. XI. The Larval Maxilla. – Mosquito Systematics Newsletter 9 (2): 128–175.
- Harbach, R. E. & K. L. Knight 1977 c: A Mosquito Taxonomic Glossary. XII. The Larval Labiohypopharynx. – Mosquito Systematics Newsletter 9 (3): 337–365.
- Harbach, R. E. & K. L. Knight 1977 d: A Mosquito Taxonomic Glossary. XIII. The Larval Pharynx. – Mosquito Systematics Newsletter 9 (3): 389–401.
- Harbach, R. E. & K. L. Knight 1978 a: A Mosquito Taxonomic Glossary. XIV. The Larval Body (except chaetotaxy). – Mosquito Systematics Newsletter 10 (1): 53–105.
- Harbach, R. E. & K. L. Knight 1978 b: A Mosquito Taxonomic Glossary. XV. The Egg. – Mosquito Systematics Newsletter 10 (2): 249–298.
- Harbach, R. E. & K. L. Knight 1978 c: A Mosquito Taxonomic Glossary. XVI. Vestiture. – Mosquito Systematics Newsletter 10 (4): 540–564.
- Harbach, R. E. & K. L. Knight 1980: Taxonomists' glossary of mosquito anatomy. – Plexus Publishing, Inc., Marlton, New Jersey. XI + 413 S.
- Harbach, R. E. & K. L. Knight 1982: Corrections and additions to Taxonomists' glossary of mosquito anatomy. Mosquito Systematics 13 (1981)(2): 201–217.
- Harbach, R. E. & R. C. Wilkerson 2023: The insupportable validity of mosquito subspecies (Diptera: Culicidae) and their exclusion from culicid classification. – Zootaxa 5303 (1): 1–184.
- Harksen, E., R. Mönke & H. Schumann 1976: Faunistisch-ökologische Untersuchungen zur StechmückenfaunaBerlins (Diptera, Culicidae). – Deutsche Entomologische Zeitschrift, Neue Folge 23: 367–406.
- Hernández-Triana, L. M., V. A. Brugman, N. I. Nikolova, I. Ruiz-Arrondo, E. Barrero, T. Thorne, M. F. de Marco, A. Krüger, S. Lumley, N. Johnson & A. R. Fooks 2019: DNA barcoding of British mosquitoes (Diptera, Culicidae) to support species identification, discovery of cryptic genetic diversity and monitoring invasive species. – ZooKeys 832: 57–76.
- Kampen, H., D. Zielke & D. Werner 2013: Der Mückenatlas: Vom Mitmach-Projekt zur Wissenschaft. – Naturwissenschaftliche Rundschau 66 (6): 285–295.
- Kampen, H., A. Schuhbauer & D. Walther 2017: Emerging mosquito species in Germany—a synopsis after 6 years of mosquito monitoring (2011–2016). – Parasitological Research 116: 3253–3263.
- Kiel, E., T. V. Dworrak, F. Sauer, L. Jaworski & R. Lühken 2019: Konfliktfeld Stechmücken und Naturschutz. – Natur und Landschaft 94 (2): 52–58.
- Knight, K. L. 1970: A Mosquito Taxonomic Glossary. I. Adult Head (External). – Mosquito Systematics Newsletter 2 (1): 23–33.
- Knight, K. L. 1971: A Mosquito Taxonomic Glossary. VII. The Pupa. – Mosquito Systematics Newsletter 3 (2): 42–65.
- Knight, K. L. & J. L. Laffoon 1970 a: A Mosquito Taxonomic Glossary. II. Adult Head (Internal). – Mosquito Systematics Newsletter 2 (2): 69–81.
- Knight, K. L. & J. L. Laffoon 1970 b: A Mosquito Taxonomic Glossary. III. Adult Thorax. – Mosquito Systematics Newsletter 2 (3): 132–146.
- Knight, K. L. & J. L. Laffoon 1970 c: A Mosquito Taxonomic Glossary. IV. Adult Thoracic Appendages. – Mosquito Systematics Newsletter 2 (4): 165–177.
- Knight, K. L. & J. L. Laffoon 1971 a: A Mosquito Taxonomic Glossary. V. Abdomen (Except Female Genitalia). – Mosquito Systematics Newsletter 3 (1): 8–24.
- Knight, K. L. & J. L. Laffoon 1971 b: A Mosquito Taxonomic Glossary. VIII. The larval chaetotaxy. – Mosquito Systematics Newsletter 3 (4): 160–194.
- Köchling, K., G. A. Schaub, M. Schäfer, D. Werner & H. Kampen 2024: Host preference of mosquitoes (Diptera: Culicidae) collected in Germany. – Journal of Vector Ecology 49 (1): 114–125.
- Kuhlisch, C. 2022: Discovery of Aedes (Ochlerotatus) pionips Dyar, 1919 (Diptera, Culicidae) in Germany. – Check List 18 (4): 897–906.
- Laffoon, J. L. & K. L. Knight 1971: A Mosquito Taxonomic Glossary. VI, Female Genitalia. – Mosquito Systematics Newsletter 3 (2): 32–41.
- Laffoon, J. L. & K. L. Knight 1973: A Mosquito Taxonomic Glossary. IX. The Larval Cranium. – Mosquito Systematics Newsletter 5 (1): 31–95.
- Lindström, A. & D. Eklöf 2022: Stickmyggor i Nordeuropa – en fälthandbok. – Entomologiska Föreningen i Stockholm, 208 S.
- Maier, W. A., J. Grunewald, B. Habedank, K. Hartelt, H. Kampen, P. Kimmig, T. Naucke, R. Oehme, A. Vollmer, A. Schöler & C. Schmitt 2003: Mögliche Auswirkungen von Klimaveränderungen auf die Ausbreitung von primär humanmedizinisch relevanten Krankheitserregern über tierische Vektoren sowie auf die wichtigen Humanparasiten in Deutschland. – Umweltforschungsplan des Bundesministeriums für Umwelt, Naturschutz und Reaktorsicherheit. – Forschungsbericht 200 61 218/11 UBA-FB 000454. – Umweltbundesamt, Berlin. 341 S.
- Mattingly, P. F. 1973: Culicidae (Mosquitoes). – In: K. G. V. Smith, Insects and other arthropods of medical importance. – British Museum, London. 37–107.
- Mohrig, W. 1964: Faunistisch-ökologische Untersuchungen an Culiciden der Umgebung von Greifswald. – Deutsche Entomologische Zeitschrift (Neue Folge) 11 (4–5): 327–352.
- Mohrig, W. 1969: Die Culiciden Deutschlands. Untersuchungen zur Taxonomie, Biologie und Ökologie der einheimischen Stechmücken. – Parasitologische Schriftenreihe, Jena 18: 260 S.
- Murray, C. J. L., L. C. Rosenfeld, S. S. Lim, K. G. Andrews, K. J. Foreman, D. Haring, N. Fullman, M. Naghavi, R. Lozano, A. D. Lopez 2012: Global malaria mortality between 1980 and 2010: a systematic analysis. – The Lancet 379 (9814): 413–431.
- Pernat, N., H. Kampen, J. M. Jeschke, D. Werner 2020: Citizen science versus professional data collection: Comparison of approaches to mosquito monitoring in Germany. – Journal of Applied Ecology: 1–10.
- Peus, F. 1950: Stechmücken. – Die Neue Brehm-Bücherei. A. Ziemsen Verlag, Wittenberg/ Lutherstadt. 80 S.
- Reinert, J. F., R. E. Harbach & I. J. Kitching 2004: Phylogeny and classification of Aedini (Diptera: Culicidae), based on morphological characters of all life stages. – Zoological Journal of the Linnean Society 142: 289–368.
- Reinert, J. F., R. E. Harbach & I. J. Kitching 2006: Phylogeny and classification of Finlaya and allied taxa (Diptera: Culicidae: Aedini) based on morphological data from all life stages. – Zoological Journal of the Linnean Society 148: 1–101.
- Reinert, J. F., R. E. Harbach & I. J. Kitching 2009: Phylogeny and classification of tribe Aedini (Diptera: Culicidae). – Zoological Journal of the Linnean Society 157: 700–794.
- Schaffner, F. & A. Mathis 2014: Dengue and dengue vectors in the WHO European region: past, present, and scenarios for the future. – The Lancet Infectious Diseases 14 (12): P1271–1280.
- Smallegange, R. C., Y. T. Qiu, J. J. A. van Loon & W. Takken 2005: Synergism between ammonia, lactic acid and carboxylic acids as kairomones in the host-seeking behaviour of the malaria mosquito Anopheles gambiae sensu stricto (Diptera: Culicidae). – Chemical Senses 30 (2): 145–152.
- Vanslembrouck, A., K. Scheers, X. Vermeersch, R. Hendrickx, A. Schneider, J. De Witte, I. Deblauwe, W. Van Bortel, F. Reuss & R. Müller 2024: Exploring the efficacy of predacious diving beetles as potential nature-based solution for combatting the invasive mosquito Aedes albopictus (Skuse, 1894). – NeoBiota 94: 179–203.
- Versteirt, V., Z. T. Nagy, P. Roelants, L. Denis, F. C. Breman, D. Damiens, W. Dekoninck, T. Backeljau, M. Coosemans & W. Van Bortel 2015: Identification of Belgian mosquito species (Diptera: Culicidae) by DNA barcoding. – Molecular Ecology Resources 15: 449–457.
- Werner, D. & H. Kampen 2019: Stechmücken-Monitoring über das Citizen-Science-Projekt "Mückenatlas". – Natur und Landschaft 94 (3): 125–127.
- Werner, D., S. Kowalczyk & H. Kampen 2020: Nine years of mosquito monitoring in Germany, 2011–2019, with an updated inventory of German culicid species. – Parasitology Research 119: 2765–2774.
- Weyer, F. 1954: Bestimmungsschlüssel für die Anopheles-Weibchen und -larven in Europa, Nordafrika und Westasien. – Merkblätter des Bernhardt-Nocht-Institutes für Schiffs- und Tropenkrankheiten Hamburg, Medizinisch wichtige Insekten, Merkblatt 12. – Johann-Ambrosius-Barth, Leipzig. 36 S.
- Wilkerson, R. C., Y.-M. Linton, D. M. Fonseca, T. R. Schultz, D. C. Price & D. A. Strickman 2015: Making mosquito taxonomy useful: A stable classification of tribe Aedini that balances utility with current knowledge of evolutionary relationships. – PLoS ONE 10 (7): e0133602.
- Wilkerson, R. C., Y.-M. Linton & D. Strickman 2021: Mosquitoes of the world. – Johns Hopkins University, Baltimore. Band 1: X+599 S., Band 2: S. I–XI, 600–1308.
- Yeo, H., T. X. Yeoh, H. Ding, T. T. M. Lee & N. Puniamoorthy 2021: Morphology and mini-barcodes: The inclusion of larval sampling and NGS-based barcoding improves robustness of ecological analyses of mosquito communities. – Journal of Applied Ecology 58: 2087–2100.
- Ziegler, J. 2003: Diptera, Zweiflügler (Fliegen und Mücken). S. 756–860. – In: H. H. Dathe, Lehrbuch der Speziellen Zoologie. Band 1: Wirbellose Tiere. 5. Teil: Insecta. – Spektrum Akademischer Verlag und Gustav Fischer Verlag Jena.
- Zittra, C. 2012: Bestimmungsschlüssel der Culiciden (Insecta: Diptera) im Nationalpark Donau Auen. – Wissenschaftliche Reihe Nationalpark Donau-Auen 27: 55 S.
Links
- Gaffigan, T. V., R. C. Wilkerson, J. E. Pecor, J. A. Stoffer & T. Anderson 1999-2019: Systematic Catalog of Culicidae. – mosquitocatalog.org
- Cypress Hansen 2021: The secret lives of mosquitoes, the world's most hated insects. – Smithsonian Magazine, August 19th, 2021
- Harbach, R. E. 2013–2020: Mosquito Taxonomic Inventory. – http://mosquito-taxonomic-inventory.info
- Kreß, A. 2013: Stechmücken fängt man mit Limburger Käse. – 7. Frankfurter Science Slam, November 2013, Physikalischer Verein. 2. Platz.
- Nuss, M. 2018: Sollten wir Mücken ausrotten? – Wilderness International-Video auf Youtube
- Reverse identification key for mosquito species
- The Walter Reed Biosystematics Unit (WRBU)
- Werner, D. & H. Kampen 2012–2025: Mückenatlas - Deutschland kartiert die Stechmücken. – Leibniz-Zentrum für Agrarlandschaftsforschung (ZALF) e.V. & Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit. – www.mueckenatlas.de
Autor(-en): Matthias Nuß, Uwe Kallweit. Letzte Änderung am 07.11.2025
|

Aedes sticticus ♀, Habitus
(© Uwe Kallweit)
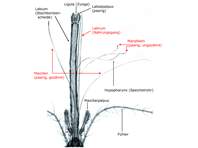
Stechrüssel eines Weibchens von Aedes punctor. Die eigentlichen Stechwerkzeuge, die in die Haut des Wirtes eindringen, sind Labrum, Maxillen und Mandibeln. Aufnahme mit dem Lichtmikroskop.
(© Uwe Kallweit)
Stechrüssel eines Weibchens von Aedes punctor. Die eigentlichen Stechwerkzeuge, die in die Haut des Wirtes eindringen, sind Labrum, Maxillen und Mandibeln. Aufnahme mit dem Lichtmikroskop. (© Uwe Kallweit)( Bild vergrößern)
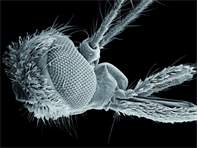
Aedes communis ♀, Kopf (Seitenansicht). Aufnahme mit dem Rasterelektronenmikroskop (REM)
(© Uwe Kallweit)
Aedes communis ♀, Kopf (Seitenansicht). Aufnahme mit dem Rasterelektronenmikroskop (REM) (© Uwe Kallweit)( Bild vergrößern)
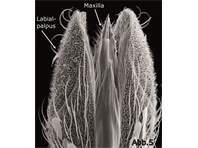
Aedes communis ♀, Rüsselspitze von oben. REM-Aufnahme
(© Uwe Kallweit)
Aedes communis ♀, Rüsselspitze von oben. REM-Aufnahme (© Uwe Kallweit)( Bild vergrößern)
|