Diagnose
Vorderflügellänge 28–32 mm.
Flügeloberseiten dunkelbraun, mit bräunlich-weißer Binde, die von dunklen Adern durchzogen ist; das Männchen im Vorderflügel am Beginn der weißen Binde mit einem Augenfleck, das Weibchen in der Mitte mit einem oder zwei weiteren Augenflecken; Innenrand der Binde auf dem Hinterflügel leicht gewinkelt.
Flügelunterseiten mit kontrastreicheren weißen Binden und Augenflecken, der Hinterflügel marmoriert.
Ähnliche Arten: Vom Großen Waldportier (Hipparchia fagi), der nicht aus Sachsen bekannt ist, nicht sicher nach äußeren Merkmalen unterscheidbar.
Der Weiße Waldportier (Brintesia circe) oberseits mit kontrastreicher weißer Binde und auf der Unterseite des Hinterflügels mit einer weißen Binde von der Mitte des Vorderrandes bis zur Flügelmitte.
Die Berghexe (Chazara briseis) oberseits heller braun, Vorderflügel mit weißem Vorderrand, die weißen Binden unregelmäßiger angeordnet und auf dem Hinterflügel verwaschen; unterseits hellbraun, Vorderflügel mit zwei kontrastreichen dunklen Augenflecken und einem deutlichen schwarzen Mittelfleck.
Gesetzlicher Schutz und Rote Liste
Gesetzlicher Schutz (BArtSchV, BNatSchG): Nicht besonders geschützt
Gesetzlicher Schutz (BArtSchV, BNatSchG): streng geschützt
Rote Liste Sachsen: vom Aussterben bedroht
Rote Liste Deutschland: stark gefährdet
Nomenklatur
- Papilio hermione Linnaeus, 1764 (vergleiche Kudrna 1977: 24; Honey, M. R. & M. J. Scoble 2001; Russel & Vane-Wright 2022; Balletto et al. 2024).
- Papilio alcyone Denis & Schiffermüller, 1775
- Eumenis fagi genava Fruhstorfer, 1908 a: 81 (Fruhstorfer 1908 b, c, 1910; Kudrna 1977: 24 (Syn.), 2001; Jutzeler et al. 2002; Jutzeler & Volpe 2006) Typenlokalität: Wallis, Stalden. Paratypen: Visperterminen, Martigny, Genf.
Merkmale
Der Kleine Waldportier ist vom Großen Waldportier (Hipparchia fagi) in der Regel durch den leicht gewinkelten Innenrand der weißen Binde auf der Oberseite der Hinterflügel zu unterscheiden. Beim Großen Waldportier ist dieser Rand gleichmäßig gebogen.
Nach Kudrna (1977) reichen diese äußeren Merkmale für eine Unterscheidung der beiden Arten nicht immer aus. Eine sichere Bestimmung ist anhand des Jullienschen Organs am Hinterleibsende der Männchen möglich. Diese Untersuchung lässt sich zwar mit einer Lupe durchführen, doch müssen zuvor die überlagernden Schuppen abgepinselt werden. Das Julliensche Organ des Kleinen Waldportiers besitzt 2 x 15–18 Stäbchenschuppen, das des Großen Waldportiers 2 x 2–3 Stäbchenschuppen.
Verbreitung
Von Marokko über Spanien und Südostfrankreich bis Mitteleuropa und Italien; isolierte Vorkommen in Südnorwegen und im Baltikum; östlich bis in den europäischen Teil Südrusslands und in die Ukraine (Tolman & Lewington 1998) sowie Türkei, Kaukasusregion und Libanon (Savela 2018).
Lebensweise
Eine Darstellung der ökologischen Ansprüche sowie der Verbreitung des Kleinen Waldportiers in Deutschland geben Kwast & Sobczyk (2000). Die Art bildet in Deutschland eine Generation, deren Hauptflugzeit sich von Juli bis Mitte August erstreckt. Die größte Aktivität zeigen die Falter in den Vormittags- und späten Nachmittagsstunden, während sie an heißen Tagen während der Mittagszeit an halbschattigen Kiefernstämmen ruhen, die ebenfalls zur Übernachtung aufgesucht werden (Kwast & Sobczyk 2000). Zum Sonnen benötigen die Tiere freie möglichst windgeschützte Stellen, die sie sowohl an Baumstämmen als auch auf der freien Sandoberfläche finden (Kwast & Sobczyk 2000). Die Männchen zeigen ein typisches Revierverhalten in der Krautschicht. Bei der verwandten Art H. fagi findet dieses Verhalten in der Baumschicht statt.
Als bedeutender Faktor für das Vorkommen gilt ein ausreichendes Angebot an Blütenpflanzen während der Flugzeit (Kwast & Sobczyk 2000). Dabei zeigen die Falter eine deutliche Bevorzugung für blau oder violett blühende Pflanzen, sodass als Nahrungsquelle in der Lausitz neben Berg-Sandknöpfchen (Jasione montana), Kleinem Habichtskraut (Hieracium pilosella) oder dem Saftausfluss junger Birken vor allem der Sand-Thymian (Thymus serpyllum) dient (Kwast & Sobczyk 2000).
Die Eiablage findet oberirdisch an Teilen der Nahrungspflanze statt. In Deutschland leben die Larven fast ausschließlich an Schwingel-Arten (Gattung Festuca) (Kwast & Sobczyk 2000). Als weitere potentielle Wirtspflanze der Larven kommt Rotstraußgras (Agrostis tenuis) in Frage. Im Gegensatz zu den beiden anderen Hipparchia-Arten (Hipparchia semele, Hipparchia statilinus) stammen bisher keine Larvennachweise von Silbergras (Corynephorus canescens) oder Landreitgras (Calamagrostis epigejos), obwohl beide Pflanzenarten häufig in den Habitaten wachsen (Kwast & Sobczyk 2000).
Wie bei vielen Augenfalterarten besitzen auch die Larven des Kleinen Waldportiers eine nachtaktive Lebensweise. Etwa Mitte Juni sind die Larven erwachsen und besitzen eine bräunliche Grundfarbe mit breiten dunklen Längsstreifen auf dem Rücken. Im Vergleich zum Kleinen Waldportier zeichnet sich die Larve von H. fagi durch schwächer ausgeprägte Rücken- und Seitenstreifen aus, wodurch eine Artunterscheidung anhand der Larven erfolgen kann (Settele et al. 2009).
Die Verpuppung erfolgt in einem hell rötlichen Kokon unter der Erde in der Nähe von Grasbüscheln.
Lebensräume
Der Kleine Waldportier ist eine stenotope Charakterart der sandigen und trockenwarmen Kiefernwälder insbesondere ihrer halbschattigen Ränder, Schneisen, Säume und Lichtungen (Kwast & Sobczyk 2000). In Verbindung zu diesen Kiefernwäldern werden Heideflächen oder Trockenrasen mit offene Bodenflächen benötigt.
Weibchen, die einen großen Teil des Eivorrates abgelegt haben, unternehmen bei hohen Populationsdichten Ausbreitungsflüge (Kwast & Sobczyk 2000). Einzelne Nachweise von Faltern können somit weit entfernt von den Larvalhabitaten erfolgen.
Bestandssituation
Deutschlandweit ist der Kleine Waldportier stark zurückgegangen. Die letzten stabilen Populationen des Kleinen Waldportiers konzentrieren sich im Gebiet der Braunkohletagegbau-Folgelandschaften in der Lausitz in Südbrandenburg und Nordsachsen. Diese Populationen in der Lausitz lassen sich darauf zurückführen, dass die geschlossenen Kiefernforste durch Strom-, Gas- oder Bahntrassen sowie Produktionsflächen des Bergbaus zergliedert und freigehalten wurden. Dadurch entstanden in unmittelbarer Nähe zu den Forsten immer wieder freie Sandflächen, die sich für die Ansiedlung und Ausbreitung der Larvennahrungspflanzen eignen (Kwast & Sobczyk 2000).
Der Kleine Waldportier zeigt starke Populationsschwankungen. Anthropogene Einflüsse, die zu einer Veränderung der Habitate beitragen oder die Entwicklung der Larven nachteilig beeinflussen, können zu lokalen Aussterbeereignissen führen (Kwast & Sobczyk 2000).
Literatur
- Balletto, E., F. Barbero, S. Bonelli, L. P. Casacci & L. Dapporto 2024: On Linnaeus’ (1764) butterfly type materials missing from the Museum of Evolution of Uppsala University (Section of Zoology) and the case of Papilio hermione. – Nota Lepidopterologica 47: 163–170.
- Ebert, G. & E. Rennwald 1993: Die Schmetterlinge Baden-Württembergs. Band 2: Tagfalter II. – Eugen Ulmer, Stuttgart. 535 S.
- Fruhstorfer, H. 1908 a: Lepidopterologisches Charivari. – Entomologisches Wochenblatt (Insekten-Börse) 25 (19): 80–82.
- Fruhstorfer, H. 1908 b: Ueber ein neues Organ der Rhopaloceren. – Entomologische Zeitschrift, Frankfurt am Main 12 (12): 50.
- Fruhstorfer, H. 1908 c: Neues über das Jullienische Organ. – Entomologische Zeitschrift, Frankfurt am Main 22 (24) : 94–99.
- Fruhstorfer, H. 1910: Neues über Eumenis fagi und alcyone. – Entomologische Zeitschrift, Frankfurt am Main 24
(14) : 71–73, (15): 75–77, (16): 82–83, (17): 86–88.
- Honey, M. R. & M. J. Scoble 2001: Linnaeus’s butterflies (Lepidoptera: Papilionoidea and Hesperioidea). – Zoological Journal of the Linnean Society 132 (3): 277–399.
- Jutzeler, D., T. Lafranchis, J. Olivares & G. Volpe 2002: Trois taxons du complexe d’ Hipparchia alcyone (Denis et Schiffermüller, 1776) en comparaison: ssp. vandalusica (sensu Oberthür, 1894, nec Leraut, 1990), ssp. pyrenaea (Oberthür, 1894) et alcyone de l’Italie méridionale (Lepidoptera: Nymphalidae, Satyrinae). – Linneana Belgica 18 (6): 273–288.
- Jutzeler, D. & G. Volpe 2005: Confirmation de la dualité du ‘Petit Sylvandre’ diagnostiquée par Leraut (1990). 1ère partie: clarifications nomenclaturales et comparaison des stades larvaires d’ Hipparchia alcyone Denis et Schiffermüller (1775) et d’ H. genava Fruhstorfer (1908) (Lepidoptera: Nymphalidae, Satyrinae). – Linneana Belgica 20 (4): 145–157, 4 Taf.
- Jutzeler, D. & G. Volpe 2006: Confirmation de la dualité du ‘Petit Sylvandre’ diagnostiquée par Leraut (1990). 2ème partie: comparaison des caratères et des genitalia d’Hipparchia alcyone Denis et Schiffermüller (1775) et d’H. genava Fruhstorfer (1908) (Lepidoptera: Nymphalidae, Satyrinae). – Linneana Belgica 20 (5): 193–206.
- Jutzeler, D. 2017: Doubts about the validity of the species name Hipparchia hermione Linnaeus, 1864 (Lepidoptera: Satyrinae) introduced by Kudrna (1977). – Entomologica romanica 20 (2016): 5–56.
- Kudrna, O. 1977: A revision of the genus Hipparchia Fabricius. – E. W. Classey Ltd, Faringdon, Oxon. 300 S.
- Kudrna, O. 2001: Miscellaneous notes on the taxonomy of four European butterflies (Lepidoptera: Rhopalocera): On the identity, status and type material of Eumenis fagi genava Fruhstorfer, 1907. – Entomologist’s Gazette 52: 255–258.
- Kwast, E. & T. Sobczyk 2000: Ökologische Ansprüche und Verbreitung des Kleinen Waldportiers Hipparchia alcyone (Denis & Schiffermüller, 1775) in der Bundesrepublik Deutschland (Lep., Satyridae). – Entomologische Nachrichten und Berichte 44 (2): 89–99.
- Lange, M., J. Gelbrecht, M. Wiemers & T. Schmitt 2025: What makes a habitat suitable for the open-forest specialist rock grayling (Hipparchia alcyone [Denis & Schiffermüller], 1775)? An ecological comparison between current and historical habitats of a highly endangered butterfly species. – Journal of Insect Conservation 29 (2): 20.
- Lorkovic, Z. 1976: Taxonomische, ökologische und chorologische Beziehungen zwischen Hipparchia fagi Scop., H. syriaca Stgr. und H. alcyone D. & S. (Lepidopt. Satyridae). – Acta ent. Jugoslavia 12: 11–33.
- Russel, P. J. C. & R. I. Vane-Wright 2022: Papilio hermione Linnaeus, type species of Hipparchia Fabricius (Lepidoptera, Satyrinae): restoring stability to the application of these names. – Nota lepidopterologica 45: 279–294.
- Settele, J., R. Feldmann & R. Reinhardt 1999: Die Tagfalter Deutschlands. – Eugen Ulmer, Stuttgart. 452 S.
- Settele, J., Steiner, R., Reinhardt, R., Feldmann, R. & G. Hermann 2015 (3. Aufl.): Schmetterlinge. Die Tagfalter Deutschlands. – Ulmer, Stuttgart.
256 S.
- Steiniger, H. & U. Eitschberger 1982: Über ein sympatrisches Vorkommen von Hipparchia fagi (Scopoli, 1763) und Hipparchia alcyone (Denis & Schiffermüller, 1775) in Spanien. – Atalanta 13 (1): 66–71.
- Tolman, T. & R. Lewington 1998: Die Tagfalter Europas und Nordwestafrikas. – Franckh-Kosmos, Stuttgart. 319 S., 104 Tafeln. (Übersetzung und fachliche Bearbeitung der 1. Aufl. von M. Nuss; 2. Aufl. 2012 von Heidrun Melzer).
- Weidemann, H.-J. 1988: Tagfalter. Band 2 Biologie - Ökologie - Biotopschutz. – Neumann-Neudamm, Melsungen. 372 S.
Links
Autor(-en): Susanne Kurze, Matthias Nuß. Letzte Änderung am 13.01.2026
|

Spreetaler Heide, Nähe Neustadt/Schleife, 29.06.2013
(© Eva-Maria Bäßler )
Spreetaler Heide, Nähe Neustadt/Schleife, 29.06.2013 (© Eva-Maria Bäßler )( Bild vergrößern)

Spreetaler Heide, Nähe Neustadt/Schleife, 29.06.2013
(© Eva-Maria Bäßler )
Spreetaler Heide, Nähe Neustadt/Schleife, 29.06.2013 (© Eva-Maria Bäßler )( Bild vergrößern)

Kringelsdorf , August 2022
(© Wolfgang Gordziel)
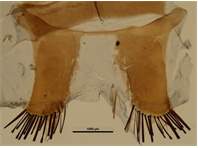
Julliensches Organ am Abdominaltergit 8 des Männchens des Kleinen Waldportiers. Zossen (Brandenburg), Übungsplatz, 23.07.1941, leg. J. Skell. Coll. Senckenberg Museum für Tierkunde Dresden. Prep. MTD 18 Jennifer Wintergerst.
(© Jennifer Wintergerst & Matthias Nuß)
Julliensches Organ am Abdominaltergit 8 des Männchens des Kleinen Waldportiers. Zossen (Brandenburg), Übungsplatz, 23.07.1941, leg. J. Skell. Coll. Senckenberg Museum für Tierkunde Dresden. Prep. MTD 18 Jennifer Wintergerst. (© Jennifer Wintergerst & Matthias Nuß)( Bild vergrößern)
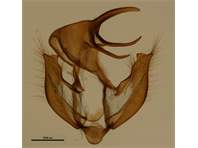
Männliches Genital des Kleinen Waldportiers. Zossen (Brandenburg), Übungsplatz, 23.07.1941, leg. J. Skell. Coll. Senckenberg Museum für Tierkunde Dresden. Prep. MTD 18 Jennifer Wintergerst.
(© Jennifer Wintergerst & Matthias Nuß)
Männliches Genital des Kleinen Waldportiers. Zossen (Brandenburg), Übungsplatz, 23.07.1941, leg. J. Skell. Coll. Senckenberg Museum für Tierkunde Dresden. Prep. MTD 18 Jennifer Wintergerst. (© Jennifer Wintergerst & Matthias Nuß)( Bild vergrößern)

Phallus des Kleinen Waldportiers. Zossen (Brandenburg), Übungsplatz, 23.07.1941, leg. J. Skell. Coll. Senckenberg Museum für Tierkunde Dresden. Prep. MTD 18 Jennifer Wintergerst.
(© Jennifer Wintergerst & Matthias Nuß)
Phallus des Kleinen Waldportiers. Zossen (Brandenburg), Übungsplatz, 23.07.1941, leg. J. Skell. Coll. Senckenberg Museum für Tierkunde Dresden. Prep. MTD 18 Jennifer Wintergerst. (© Jennifer Wintergerst & Matthias Nuß)( Bild vergrößern)

Weibchen des Kleinen Waldportiers. Schönfeld-Boehla ("Ortrand"), 01.08.1927, leg. J. Skell. Coll. Senckenberg Museum für Tierkunde Dresden. Prep. MTD 19 Jennifer Wintergerst.
(© Jennifer Wintergerst & Matthias Nuß)
Weibchen des Kleinen Waldportiers. Schönfeld-Boehla ("Ortrand"), 01.08.1927, leg. J. Skell. Coll. Senckenberg Museum für Tierkunde Dresden. Prep. MTD 19 Jennifer Wintergerst. (© Jennifer Wintergerst & Matthias Nuß)( Bild vergrößern)
|