Diagnose
Flügeloberseiten orange mit schwarzen Adern sowie schwarzen Flecken, die zu Bändern verschmolzen sind (Gitterzeichnung). Außenrand schwarz, Fransen schwarz-weiß gescheckt.
Flügelunterseiten: Vorderflügel orange mit schwarzen Flecken. Hinterflügel mit fünf abwechselnd gelblich-weißen und orangen Bändern, die seitlich von schwarzen Linien und längs von schwarzen Adern durchzogen sind und so einzelne Zellen ergeben. Das äußere orange Band mit leuchtend orangen Punkten.
Ähnliche Arten: Nickerl`s Scheckenfalter, der Wachtelweizen-Scheckenfalter ( Melitaea athalia), Assmann`s Scheckenfalter ( Melitaea britomartis) und der Zweibrütige Scheckenfalter ( Melitaea parthenoides) sind nur durch mikroskopische Untersuchungen sicher voneinander zu unterscheiden.
Von diesen sind der Wegerich-Scheckenfalter ( Melitaea cinxia), Flockenblumen-Scheckenfalter ( Melitaea phoebe) und der Rote Scheckenfalter ( Melitaea didyma) auf der Unterseite der Hinterflügel durch das Vorhandensein schwarzer Punkte in den Zellen der basalen und mittleren weißen Bänder unterscheidbar.
Der Baldrian-Scheckenfalter ( Melitaea diamina) besitzt auf der Unterseite der Hinterflügel im äußeren orangen Band anstatt der leuchtend orangen Punkte kleine schwarze Punkte.
Gesetzlicher Schutz und Rote Liste
Rote Liste Sachsen: vom Aussterben bedroht
Rote Liste Deutschland: Vorwarnliste (noch ungefährdet)
Synonym
Papilio parthenie Borkhausen, 1788 - jüngeres, primäres Homonym von Papilio parthenie Bergträsser, 1780 und ein jüngeres Synonym von Brenthis ino
Merkmale
Die Falter von M. aurelia besitzen eine Flügelspannweite zwischen 30 bis 33 mm.
Am Kopf sind die Palpen (Lippentaster) bei den Weibchen fuchsrot und bei den Männchen schwarz mit roten Einmischungen. Eine ähnliche Färbung weisen auch die Palpen von der aus Sachsen nicht bekannten Melitaea parthenoides auf.
Die Flügelzeichnung eignet sich nicht, Melitaea aurelia von Melitaea athalia, Melitaea britomartis sowie M. parthenoides zu unterscheiden. Tendenziell fallen auf der Vorderflügeloberseite die Abstände zwischen den schwarzen Linien (Marginal-, Submarginal-,
Postdiskal- und Diskallinie) fast gleich aus. Der Außenrand der Hinterflügelunterseite (Raum zwischen den Marginallinien) besitzt eine kräftige gelbe Färbung, die bei den Männchen weiter nach innen in den Flügel reichen kann. Lenz (1917) verweist zusätzlich auf die äußere Begrenzungslinie der hellen Mittelbinde (Postdiskalbinde) auf der Hinterflügelunterseite, die sich bei M. aurelia aus eher geradlinigen Abschnitten zusammensetzt, während bei Melitaea athalia die Abschnitte stärker gebogen sind.
Nach Urbahn (1952) lösen sich die dunklen Streifen auf der Unterseite des Hinterleibes eher in Flecken auf und gehen sowohl seitlich als auch nach hinten in eine rötliche Färbung über.
Das männliche Kopulationsorgan von M. aurelia besitzt keinen Uncus (Urbahn 1952). An dem fast quadratischen Processus posteriores befindet sich ein kräftiger, leicht nach unten weisender Zahn, an dem sich sowohl ober- als auch unterhalb weitere Zähne befinden können (Kurze et al. 2009).
Verbreitung
M. aurelia besitzt in Mittel- und Osteuropa einschließlich des Balkans eine weite Verbreitung. Im Westen reicht ihr Areal bis nach Frankreich, welches sich im Süden über Deutschland und die Schweiz bis nach Italien zum Po zieht. Sowohl auf der Iberischen Halbinsel als auch im Mittelmeerraum und auf den Britischen Inseln fehlt die Art. Die nördlichsten Vorkommen liegen in Südschweden (Ebert & Rennwald 1993).
In Deutschland kommt M. aurelia überwiegend in den südlichen Kalk- und Kreidegebieten vor, wobei sie ihr Areal zunehmend nach Nordwesten erweitert (Fartmann 2004). In Sachsen stammen die letzten Funde dieser Art aus den 1970er bis 1980er Jahren (Reinhardt et al. 2007).
Lebensweise
M. aurelia fliegt in einer Generation von Anfang Juni bis Ende Juli (Anfang August), wobei die Hauptflugzeit im Westen Deutschlands Ende Juni liegt (Ebert & Rennwald 1993; Fartmann 2004). Als Nektarpflanzen dienen unter anderem die Witwenblume (Knautia spec.), Liguster (Ligustrum vulgare), Weißklee (Trifolium repens) und Tauben-Skabiose (Scabiosa columbaria), die die Falter häufig aufsuchen (Ebert & Rennwald 1993; Fartmann 2004, Settele et al. 2009). Die Weibchen heften die Eier in Gelegen von 50 bis 200 Eiern an die Blattunterseite der Wirtspflanze (Eichel & Fartmann 2008). Etwa 18 Tage nach der Eiablage schlüpfen die Larven und leben in einem Gespinst an der Wirtspflanze, in welchem sie nah an der Bodenoberfläche überwintern (Eichel & Fartmann 2008). Für die Larven von M. aurelia ist eine schwarze Grundfarbe mit weißen Sprenkeln und an der Basis rötlich gefärbten Scheindornen typisch (Urbahn 1952). Im April oder Mai findet die Verpuppung als schwarz weiß gemusterte Stürzpuppe statt (Eichel & Fartmann 2008). Über die Wirtspflanzen der Larven existieren in der Literatur verschiedene Angaben. Nach Fartmann (2004) ernähren sich die Larven im Diemeltal (Nordwestdeutschland) ausschließlich von Mittlerem Wegerich (Plantago media), während Settele et al. (2009) Spitzwegerich (Plantago lanceolata) angeben und darauf verweisen, dass wahrscheinlich auch Kleiner Klappertopf (Rhinanthus minor) und Wachtelweizen (Melampyrum spec.) genutzt wird.
Es existieren nur wenige Kenntnisse über die Populationsökologie von M. aurelia, wobei bisherige Beobachtungen vermuten lassen, dass die Art in der Regel in einem Metapopulationssystem auftritt (Fartmann 2004).
Lebensräume
Bei M. aurelia handelt es sich um eine typische Art der extensiv genutzten Kalkmagerrasen auf trocken-warmen Standorten, die in der Regel dem Vegetationstyp der Enzian-Fiedezwenken-Rasen (Gentiano-Koelerietum) angehören (Ebert & Rennwald 1993). Besonders bevorzugt die Art südausgerichtete Hänge (Fartmann 2004). Fartmann (2004) verweist zusätzlich auf den Blütenreichtum und die geringe Nutzungsintensität der von M. aurelia präferierten Gebiete. Darüber hinaus werden Geröllhalden und Bahndämme besiedelt (Settele et al. 1999). Die Bedeutung von Mooren oder Feuchtwiesen als Lebensraum von M. aurelia ist unklar. Möglicherweise nutzen die Falter in solchen Gebieten trockene Kleinststandorte (Settele et al. 1999). Ebert & Rennwald (1993) nennen aus Baden-Württemberg nur einen isolierter Fundpunkt von M. aurelia in einer Feuchtwiese mit „trockenen Hängen“.
Bestandssituation
Die Gefährdung von M. aurelia ergibt sich aus der Nutzungsaufgabe und der damit verbundenen Verbuschung oder der Intensivierung von Trockenrasen (Settele et al. 2009). Aufgrund des gemeinsamen Vorkommens mit den verwandten Arten Melitaea athalia, Melitaea britomartis oder Melitaea parthenoides existieren nur begrenzte Kenntnisse über die Ökologie und den Erhaltungszustand der Art (Ebert & Rennwald 1993).
In Sachsen ergibt sich für die schon immer seltene M. aurelia seit dem 19. Jahrhundert ein negativer Bestandstrend. Der letzte Nachweis stammt aus dem Jahr 1970 (Reinhardt et al. 2007).
Literatur
- Ebert, G. & E. Rennwald 1993: Die Schmetterlinge Baden-Württembergs. Band 1: Tagfalter 1. – Eugen Ulmer, Stuttgart. 552 S.
- Fartmann, T. 2004: Die Schmetterlingsgemeinschaften der Halbtrockenrasen-Komplexe des Diemeltals. Biozönologie von Tagfaltern und Widderchen in einer alten Hudelandschaft. – Abhandlungen aus dem Westfälischen Museum für Naturkunde 66 (1): 1–256.
- Eichel, S. & T. Fartmann 2008: Management of calcareous grasslands for Nickerl’s fritillary (Melitaea aurelia) has to consider habitat requirements of the immature stages, isolation, and patch area. – Journal of Insect Conservation 12 (6): 677–688.
- Jugovic, J. & T. Koren 2014: Wing pattern morphology of three closely related Melitaea (Lepidoptera, Nymphalidae) species reveals highly inaccurate external morphology-based species identification. – Nota lepidopterologica 37 (1): 75–90.
- Kurze, S., B.-J. Kurze & M. Nuss 2009: Artabgrenzung beim Wachtelweizen-Scheckenfalter Melitaea athalia (Rottemburg, 1775) (Insecta: Lepidoptera). – Märkische Entomologische Nachrichten 11 (1): 25–46, 7 Taf.
- Lenz, F. 1917: Über die Melitaeen der Umgegend Münchens, ihre Raupen und ihre Puppen. – Mitteilungen der Münchner Entomologischen Gesellschaft 8: 26–39.
- Reinhardt, R., Sbieschne, H., Settele, J., Fischer, U. & G. Fiedler 2007: Tagfalter von Sachsen. In: Klausnitzer, B. & R. Reinhardt (Hrsg.): Beiträge zur Insektenfauna Sachsens. – Entomologische Nachrichten und Berichte, Beiheft 11, Dresden. 695 S.
- Settele, J., R. Feldmann & R. Reinhardt 1999: Die Tagfalter Deutschlands. – Eugen Ulmer, Stuttgart. 452 S.
- Settele, J., Steiner, R., Reinhardt, R., Feldmann, R. & G. Hermann (Hrsg.) 2009: Schmetterlinge. Die Tagfalter Deutschlands. 2. Aufl. – Ulmer, Stuttgart. 256 S.
- Urbahn, E. 1952: Die Unterschiede der Jugendstände und Falter von Melitaea athalia Rott., britomartis Assm. und parthenie Bkh. = aurelia Nick. in Deutschland (Lep.). – Zeitschrift der Wiener entomologischen Gesellschaft 37 (63) (7/8): 105-121, Taf. 12-15.
- Weidemann, H.-J. 1988: Tagfalter. Band 2 Biologie - Ökologie - Biotopschutz. – Neumann-Neudamm, Melsungen. 372 S.
Links
Autor(-en): Susanne Kurze, Matthias Nuß. Letzte Änderung am 31.03.2016
|

Flügeloberseite eines männlichen Falters von Melitaea aurelia, Slowenien, Veldes, 1942, Dannehl leg., MTD
(© Susanne Kurze)
Flügeloberseite eines männlichen Falters von Melitaea aurelia, Slowenien, Veldes, 1942, Dannehl leg., MTD (© Susanne Kurze)( Bild vergrößern)

Flügeloberseite eines weiblichen Falters von Melitaea aurelia, Mauer bei Wien, 20.06.1933, Schweiz, Wallis, Martigny, MTD
(© Susanne Kurze)
Flügeloberseite eines weiblichen Falters von Melitaea aurelia, Mauer bei Wien, 20.06.1933, Schweiz, Wallis, Martigny, MTD (© Susanne Kurze)( Bild vergrößern)

Flügelunterseite eines männnlichen Falters von Melitaea aurelia, Slowenien, Veldes, 1942, Dannehl leg., MTD
(© Susanne Kurze)
Flügelunterseite eines männnlichen Falters von Melitaea aurelia, Slowenien, Veldes, 1942, Dannehl leg., MTD (© Susanne Kurze)( Bild vergrößern)
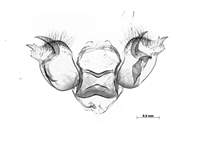
Männliches Kopulationsorgan von Melitaea aurelia, Serbien, Donji Milanovac, Eisernes Tor, 18.-19.06.1934, MTD (prep. S. Kurze)
(© Susanne Kurze)
Männliches Kopulationsorgan von Melitaea aurelia, Serbien, Donji Milanovac, Eisernes Tor, 18.-19.06.1934, MTD (prep. S. Kurze) (© Susanne Kurze)( Bild vergrößern)
|