Diagnose
Vorderflügellänge: 70–85 mm.
Vorderflügel: Grundfarbe weißlich grau bis beige, mit zahlreichen sehr kleinen (ca. 1 mm langen) schwarzen Strichen sowie olive grünen bis braunen Zeichnungselementen: eine schräge, klar abgegrenzte Binde und drei Flecken, einer an der Flügelbasis, ein weiterer etwa auf der Hälfte zwischen Flügelbasis und -spitze und der dritte in Form eines quer zum Flügel liegenden Kommas zwischen dem zweiten Fleck und der Flügelspitze.
Hinterflügel: Vorwiegend pink mit einer breiten schwarzen Bande an der Flügelbasis, sowie einer weiteren, viel schmaleren, die etwas vom Flügelrand abgesetzt ist.
Hinterleib: Grundfarbe braun; die ersten drei Segmente beidseitig mit weißen und schwarzen Arealen.
Ähnliche Art: Labkrautschwärmer (Hyles gallii), jedoch in Sachsen grünlicher und deutlich heller im Bereich des Vorderflügelrandes.
Gesetzlicher Schutz und Rote Liste
Gesetzlicher Schutz (BArtSchV, BNatSchG): besonders geschützt
Rote Liste Deutschland: gefährdet
Merkmale
Die Art besteht aus zahlreichen lokal angepassten Populationen, die als Larve und Falter eigene morphologische Ausprägungen haben können und daher teilweise als eigene Arten geführt wurden (z. B. Hyles cretica auf Kreta). Die hohe Variabilität im gesamten Verbreitungsgebiet ist bemerkenswert (Abb. 1, Hundsdörfer et al. 2019) und führte zu einer überzogenen taxonomischen Aufspaltung in mehr als 100 Artgruppennamen, wofür oft nur wenige Individuen, zuweilen sogar Geschwistertiere, betrachtet wurden, was bei der beobachteten phänotypischen Plastizität allerdings als Vergleich nicht ausreicht.
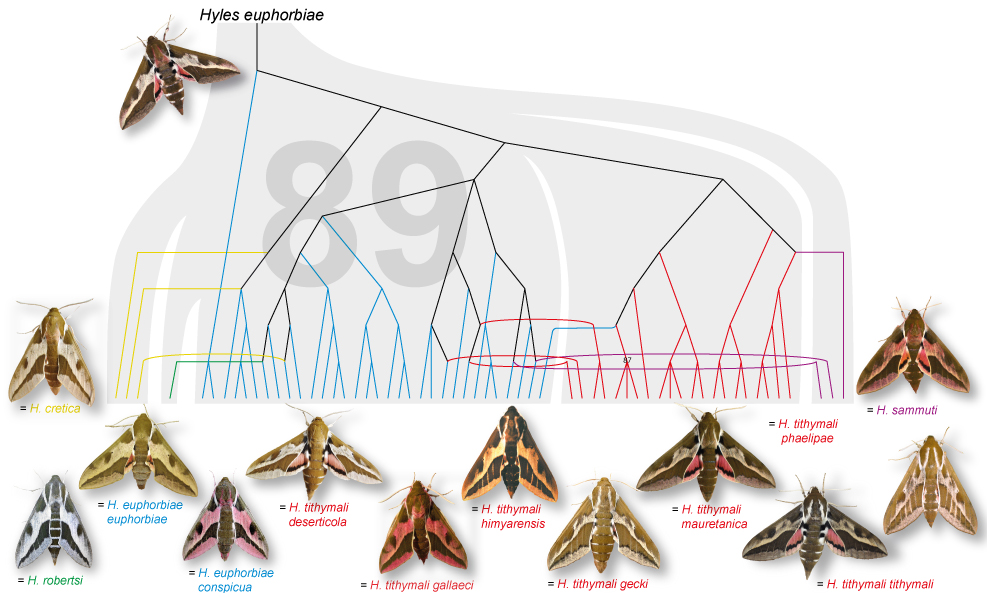
Abb. 1: Ergebnis der Koaleszenz Analyse von 835 unabhängigen genetischen Polymorphismen (Single Nucleotide Polymorphisms, SNPs) aus 160.778 kerngenomischen DNA-Basenpaaren des Hyles euphorbiae-Komplexes (HEC), auf dessen Basis alle Namen der Gruppe mit H. euphorbiae synonymisiert wurden (Hundsdörfer et al. 2019). Grau im Hintergrund der Baum, für den die Artenzugehörigkeit der Individuen vordefiniert wurde (SNPs der Individuen werden als festgelegte Gruppe je nach ihrer traditionell definierten Art analysiert), mit lediglich einem Unterstützungswert (89 Prozent für ehemalige cretica, euphorbiae plus robertsi). Darübergelegt ist der farbige Baum bei Analyse der Daten für jedes Individuum einzeln, ebenfalls mit lediglich einem unterstützen Ast (87 Prozent für einen kleinen Ast innerhalb tithymali). Keine der ehemaligen, traditionell definierten Arten wird als monophyletische Gruppe unterstützt und somit bestätigt, daher werden sie nur noch als Populationen angesehen (und die Namen nicht kursiv geschrieben, da es keine Taxonnamen mehr sind).
Imago: Die Vorderflügel sind immer spitz, die Hinterflügel immer abgerundet. Das Muster der Vorderflügel kommt in zwei Grundformen vor, von der die blasse Variante (besonders deutlich in den Populationen conspicua, cretica) im Norden und Osten des Verbreitungsgebiets vorherrscht (Mitteleuropa und Asien), während die kräftigere, braune im nördlichen Afrika und auf den Makaronesischen Inseln häufiger vorkommt (Populationen tithymali, gecki, deserticola). Die nördliche Variante kommt aber auch in Nordafrika vor (Populationen sammuti, mauretanica) und die kräftig braune Variante auch in Asien. Die genetische Grundlage der Flügelmuster ist noch nicht geklärt. Die nördliche Variante beinhaltet einen blassen, cremefarbenen oder nahezu weißen (Population robertsi, peplidis) Mittelstreifen auf dem Vorderflügel mit einer olivbraunen, schrägen, klar abgegrenzten Bande und zwei olivbraunen Flecken (einer an der Flügelbasis an der Costa und der andere, etwa auf der Hälfte zwischen Flügelbasis und Apex mit mehr Abstand zur Costa). Es gibt dunklere Ausprägungen, in denen die Costa olivbraun überzogen ist und sich diese Farbe zu verschiedenen Graden in die Mitte des Flügels ausbreitet, bis hin zur starken Ausprägung dieser dunklen Färbung bei der südlichen Variante. Der Übergang zum hellen Hintergrund ist hierbei klar abgegrenzt oder diffus. Besonders apikal kann das olivbraun der Costa weit in Richtung oder gänzlich bis zur olivbraunen Binde reichen. Hinzu kommt in einigen nordafrikanischen Populationen (tithymali, deserticola, gecki, himyarensis), dass die Vorderflügeladern im Bereich der olivgrünen Binde beige oder weiß hervorgehoben sind. Die Fühler sind bei beiden Geschlechtern distal spitz zulaufend und bei den Weibchen basal deutlich schmäler zulaufend. Pilifer mit langen Setae medial, kurzen Setae lateral (Pittaway 1997–2021). Augen bewimpert. Labialer Palpus glatt geschuppt ohne aufrechte Haare, verbirgt die Basis des Rüssels. Das Abdomen ist konisch spitz (Männchen spitzer als Weibchen).
Eier: Fast 1 mm groß und blassgrün.
Larve: Die L1-Larven sind schwarz, ab der L2 grün, gelb, weiß und schwarz gefleckt. Ab der L4 kommt manchmal schon etwas rot hinzu, spätestens aber nach der letzten Häutung zu der aposematisch gefärbten L5. Die Kopfkapsel, der Dorsalstreifen und das Horn sind dann meist rot (manchmal orange). Seitlich sind pro Segment zwei Augenflecken angeordnet (weiß, beige oder seltener rot) und der Grad an Bedeckung der meist rot/orangenen Grundfarbe durch schwarz variiert. Ebenso variabel ist die Anzahl der hellen Rieselflecken auf dem Schwarz. Besonders das letzte Larvenstadium weist einen sehr hohen Grad an Polymorphismus auf. Es gibt eine große Variabilität an Farbformen, wovon manche geographische Verbreitung zeigen und wie bei den Adulten gibt es ein nördliches und ein südliches Grundmuster (Abb. 2). Andere Farbformen scheinen unter Umwelteinfluss zu stehen. Elemente der Musterung, die in Taxonomie und Systematik verwendet wurden, betreffen die Anzahl der Augenflecken auf den Segmenten, den Umriss dieser Augenflecken, den Anteil der schwarzen Bedeckung um diese herum, wieviel diese schwarzen Bereiche mit hellen Rieselflecken versehen sind, die Ausprägung dieser Rieselflecken sowie die Farbe des lateralen Feldes. Natürlich variieren auch die Farben der Kopfkapsel, der Dorsallinie, der pedalen Linie, der abdominalen Pseudobeine, des analen Nachschiebers sowie des Horns (basal).
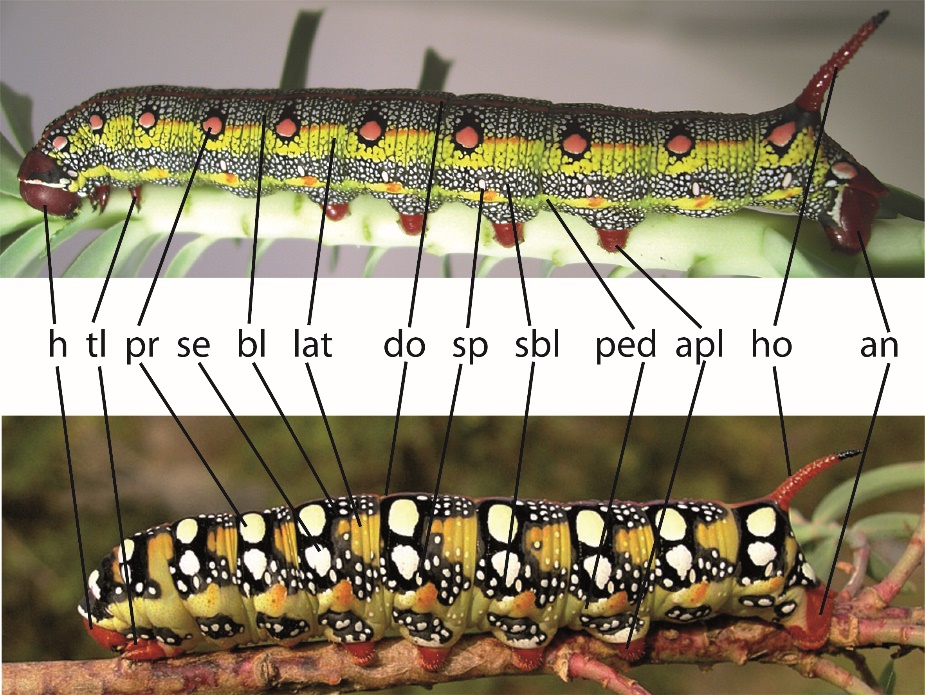
Abb. 2: Zeichnungselemente der Larven von Hyles euphorbiae in zwei Ausprägungen. Oben: bei einem Individuum aus Tunesien (Foto: Anna K. Hundsdörfer) mit dem typischen südlichen Grundmuster und Unten: bei einem Individuum aus Bulgarien (Foto: A. R. Pittaway) mit dem typisch nördlichen Grundmuster (beide aus Hundsdörfer et al., 2011).
Abkürzungen (aus der Publikation auf Englisch): h = head capsule; tl = thoracic legs; pr = primary eye-spot; se = secondary eye-spot; bl = subdorsal black pigmentation with small speckles or slightly larger dots; lat = coloured lateral field in the shape of a lateral line or a triangle; do = dorsal line; sp = spiracle; sbl = spiracular black pigmentation; ped = pedal (subspiracular) line; apl = abdominal prolegs; an = anal prolegs; ho = anal horn.
Puppe: Glatt, Proboscis mit dem Körper fusioniert, in einem Kokon im Boden.
Verbreitung
Von Großbritannien und Skandinavien südlich bis zu den Kapverden, Marokko, Tunesien, Jemen und dem Iran sowie östlich bis China und Japan (Pittaway 1997–2021; Pittaway & Kitching 2000-2021; Kitching 2013–2021). In vielen Gegenden der U.S.A. und Kanada ist die Art heimisch geworden, nachdem sie ausgesetzt wurde, um invasive Euphorbiapflanzen zu kontrollieren (Hodges 1971; Batra 1983).
Lebensweise
Die Falter des Wolfsmilchschwärmers sind dämmerungs- und nachtaktiv (in Mitteleuropa bis Mitternacht) und ernähren sich von Blütennektar, z. B. von Nachtkerzen (Oenothera sp.), Weidenröschen (Epilobium sp.) und Natternkopf (Epilobium vulgare). Sie fliegen in Sachsen zwischen Mai und Juli, kommen selten ans Licht und werden daher nie zahlreich angetroffen. In wärmeren Gegenden entwickelt sich eine zweite Generation, so in Italien beispielsweise bis Oktober, und auf den Kanarischen Inseln überlappen sich die Generationen, so dass die Art nahezu ganzjährig anzutreffen ist.
Die Weibchen legen die Eier in Trauben ab, in Sachsen an die einheimische Wirtspflanze Zypressen-Wolfsmilch (Euphorbia cyparissias). Die Larven fressen gleich nach dem Schlupf ihre Eihülle auf, spätere Stadien fressen ihre abgestreifte Larvenhaut auf. In den ersten Larvenstadien (L1–L3) bleiben die Larven dicht beieinander oder zumindest an der gleichen Nahrungspflanze. Im letzten Stadium (L5) konsumieren sie die Blätter mehrerer Sprosse von E. cyparissias pro Tag.
Die Larven zeigen mit ihrer auffälligen und bunten Musterung eine aposematische Färbung. Ihre Nahrungspflanzen der Gattung Euphorbia enthalten hautreizende, Tumor-fördernde und auch giftig wirkende Inhaltsstoffe. Zur Abwehr spucken die Larven bei Störung blitzschnell Pflanzenbrei aus ihrem Verdauungstrakt auf den Angreifer. Es wird angenommen, dass dieser noch genauso schädlich ist, wie die Pflanze selbst. Chemisch-ökologische Experimente (Hundsdörfer et al. 2019) deuteten darauf hin, dass sie ihre potentiellen Prädatoren mit der Warntracht nur vor ihrem giftigen Darminhalt warnen, d. h. entgegen verbreiteter Vorstellung speichern sie die giftigen Substanzen aus der Nahrungspflanze nicht, sondern bauen sie ab und/oder scheiden sie wieder aus (Hundsdörfer & Wink 2005). Wie die Larven die schädlichen Pflanzeninhaltsstoffe aus der Wolfmilch entgiften ist Gegenstand aktueller Forschungen.
Entlang ihrer sehr weiten Verbreitung sind überwinternde Diapausepuppen von Hyles euphorbiae sehr unterschiedlichen Temperaturen ausgesetzt, von milden durchschnittlichen 11°C im Winter des mediterranen Klimas zu durchschnittlich -23°C oder darunter in Sibirien.
Um zu verstehen inwieweit Prozesse wie phänotypische Plastizität von Frostschutzmechanismen oder lokale Anpassung an Temperaturen unter dem Gefrierpunkt die heutige Verbreitung erklärt, werden molekularen Mechanismen der Reaktion auf Kälte untersucht (Stuckas et al. 2014). Im Transkriptom dieser Art (Barth et al. 2018) wurden Kandidatengene für Kältetoleranz gefunden, aber der Mechanismus wird noch weiter erforscht. Neu erkannt wurde, dass auch Puppen aus tithymali-Populationen bei voriger Akklimatisation kurzfristig den Frostschutz in der Hämolymphe anpassen und kälteinduzierte Diapause möglich ist (Daneck et al. 2021). Die phänotypische Reaktion der Diapausepuppen auf Kältestress unterscheidet sich jedoch deutlich bei den beiden Populationen, da nur die Kälte-akklimatisierte Diapausepuppen von euphorbiae starken Frost überleben können (Daneck et al. 2021) und somit weitere Mechanismen aufweisen müssen.
Lebensräume
Die Art ist eng an das Vorkommen ihrer Nahrungspflanzen aus der Gattung Euphorbia gebunden. Die Larven fressen nahezu alle krautigen und buschigen (nicht sukkulenten) Arten, mit Ausnahme der einheimischen E. peplus und E. balsamifera von den Kanarischen Inseln. Daher kommen die Larven auf trockenen Wiesen und Feldrändern (E. cyparissias), am Rande von feuchteren, nährstoffreichen Wiesen (z. B. in Italien E. esula), am steinigen Wegesrand (z. B. in Spanien E. segetalis, E. serrata), an den Sandstränden und Binnendünen der Kanarischen Inseln und Südeuropas (E. peplidis), an felsigen Abhängen (z. B. auf den Kanarischen Inseln E. obtusifolia und E. regis-jubae, auf Sizilien E. dendroides, in Italien E. characias) oder auf kargen, sonnigen Hügeln (z. B. E. myrsinites in Griechenland) vor.
Bestandssituation
In Sachsen sind die Larven noch leicht in trockenen, offenen Habitaten mit Beständen der einheimischen Nahrungspflanze Zypressen-Wolfsmilch (Euphorbia cyparissias) zu finden.
Literatur
- Barth, M. B., K. Buchwalder, A. Y. Kawahara, X. Zhou, S. Liu, N. Krezdorn, B. Rotter, R. Horres & A. K. Hundsdörfer 2018: Functional characterization of the Hyles euphorbiae hawkmoth transcriptome reveals strong expression of phorbol ester detoxification and seasonal cold hardiness genes. – Frontiers in Zoology 15: 20.
- Batra, S. W. T. 1983: Establishment of Hyles euphorbiae (L.) (Lepidoptera: Sphingidae) in the United States for control of the weedy spurges Euphorbia esula L. and E. cyparissias L. – Journal of the New York Entomological Society 91: 304–311.
- Daneck, H., M. B. Barth, M. Geck & A. K. Hundsdörfer 2021: Super cooling point phenotypes and cold resistance in Hyles euphorbiae hawk moths from different climate zones. – Diversity 13: 207.
- Harbich, H. 1976 a: Biologische und morphologische Untersuchungen an Hybriden zwischen Hyles euphorbiae (Linné, 1758) und Hyles galii (Rottemburg, 1775) 1. Teil (Lep. Sphingidae). – Atalanta 7: 74-84.
- Harbich, H. 1976 b: Biologische und morphologische Untersuchungen an Hybriden zwischen Hyles euphorbiae (Linné, 1758) und Hyles galii (Rottemburg, 1775) 2. Teil (Lep. Sphingidae). – Atalanta 7:120–132.
- Harbich, H. 1976 c: Isolationsmechanismen und Arterhaltung im Genus Celerio (Lep., Sphingidae). – Entomologische Zeitschrift 86: 33–42.
- Harbich, H. 1984: Untersuchungen an Sphingidenhybriden des Genus Hyles, ausgehend von Hyles hybr. livornica x gallii (Lep.: Sphingidae). – Entomologische Zeitschrift 94: 289–296.
- Harbich, H. 1988: Der Hyles euphorbiae-Komplex – ein taxonomisches Problem? (Lepidoptera: Sphingidae) 1. Teil. – Entomologische Zeitschrift 98: 81–96.
- Harbich, H. 2000: Der Hyles euphorbiae-Komplex – ein taxonomisches Problem? (Lepidoptera: Sphingidae) 8. Teil. – Entomologische Zeitschrift 110: 301–304.
- Harbich, H. 2009: Anmerkungen zur Wolfsmilchschwärmerpopulation (Hyles euphorbiae (Linnaeus, 1758)-Komplex) von Malta (Lepidoptera: Sphingidae). – Entomologische Zeitschrift 119: 51–58.
- Harbich, H. & A. K. Hundsdörfer 2006: Untersuchungen an einem Hyles Freilandhybriden aus Nord Tunesien (Lepidoptera: Sphingidae). – Entomologische Zeitschrift 116: 99–106.
- Hodges, R. W. 1971: Sphingoidea, Hawkmoths. – In: R. B. Dominick et al., The moths of America north of Mexico (including Greenland), 21: xii, 158 S., 14 Taf.
- Hundsdörfer, A. K., I. J. Kitching & M. Wink 2005: A molecular phylogeny of the hawkmoth genus Hyles (Lepidoptera: Sphingidae, Macroglossinae). – Molecular Phylogenetics and Evolution 35: 442–458.
- Hundsdörfer, A. K., I. J. Kitching & M. Wink 2005: The morphological variability of Hyles t. tithymali (Boisduval) (Sphingidae: Lepidoptera) caterpillars on the Canary Islands. – Entomologische Zeitschrift 115: 29–33.
- Hundsdörfer, A. K., I. J. Kitching & M. Wink 2005: The phylogeny of the Hyles-euphorbiae complex (Lepidoptera: Sphingidae): molecular evidence from sequence data and ISSR-PCR fingerprints. – Organisms, Diversity & Evolution 5: 173–198.
- Hundsdörfer, A. K. & M. Wink 2005: Sequestration of phorbol esters by aposematic larvae of Hyles euphorbiae? – Chemoecology 15: 261–267.
- Hundsdörfer, A. K. & M. Wink 2006: Incongruence of morphology and genetic markers in Hyles tithymali (Lepidoptera: Sphingidae) from the Canary Islands. – Journal of Zoological Systematics and Evolutionary Research 44: 316–322.
- Hundsdörfer, A. K., M. B. Mende, H. Harbich, A. R. Pittaway & I. J. Kitching 2011: Larval pattern morphotypes in the Western Palaearctic Hyles euphorbiae complex (Lepidoptera: Sphingidae, Macroglossinae). – Insect Systematics & Evolution 42: 41–86.
- Hundsdörfer, A. K., K. Buchwalder, M. A. O’Neill & S. Dobler 2019: Chemical ecology traits in an adaptive radiation: TPA-sensitivity and detoxification in Hyles and Hippotion (Sphingidae, Lepidoptera) larvae. – Chemoecology 29: 35–47.
- Hundsdörfer, A. K., K. M. Lee, I. J. Kitching & M. Mutanen 2019: Genome-wide SNP Data reveal an overestimation of species diversity in a group of Hawkmoths. – Genome Biology and Evolution 11 (8): 2136–2150.
- Mende, M. B., M. Bartel & A. K. Hundsdörfer 2016: A comprehensive phylogeography of the Hyles euphorbiae complex (Lepidoptera: Sphingidae) indicates a ‘glacial refuge belt’. – Scientific reports 6:29527.
- Stuckas, H., M. Mende & A. K. Hundsdörfer 2014: Response to cold acclimation in diapause pupae of Hyles euphorbiae (Lepidoptera, Sphingidae): candidate biomarker identification using proteomics. – Insect Molecular Biology 23: 444–456.
Links
Autor(-en): Matthias Nuß, Anna Hundsdoerfer. Letzte Änderung am 06.04.2025
|

05. August 2019 in Hoyerswerda Klein Neida am Licht
(© Martina Görner)
05. August 2019 in Hoyerswerda Klein Neida am Licht (© Martina Görner)( Bild vergrößern)

Taltitz, Dobeneck, Juni 2017
(© Michael Happ)

Borsdorf, 01.08.2020, nachts am Licht.
(© Dieter Haugk)

Larve im vorletzten Stadium am 09.07.2014 in Radebeul
(© Franziska Bauer)
Larve im vorletzten Stadium am 09.07.2014 in Radebeul (© Franziska Bauer)( Bild vergrößern)

Thiergarten bei Plauen/Vogtland, August 2014
(© Steffen Hintersaß)
Thiergarten bei Plauen/Vogtland, August 2014 (© Steffen Hintersaß)( Bild vergrößern)

Larve an Zypressenwolfsmilch, mehrere Exemplare im Garten, September 2016 in Pretzschendorf
(© Angela Kühne)
Larve an Zypressenwolfsmilch, mehrere Exemplare im Garten, September 2016 in Pretzschendorf (© Angela Kühne)( Bild vergrößern)

Schönbrunn, Gemeinde Bösenbrunn / Vogtl., 30.08.2019
(© Stefan Werner)
Schönbrunn, Gemeinde Bösenbrunn / Vogtl., 30.08.2019 (© Stefan Werner)( Bild vergrößern)
|