Diagnose
Vorderflügellänge 19–21 mm.
Flügeloberseiten orange mit schwarzen Adern sowie schwarzen Flecken, die zu Bändern verschmolzen sind (Gitterzeichnung). Außenrand schwarz, Fransen schwarz-weiß gescheckt.
Flügelunterseiten: Vorderflügel orange mit schwarzen Flecken. Hinterflügel mit fünf abwechselnd gelblich-weißen und orangen Bändern, die seitlich von schwarzen Linien und längs von schwarzen Adern durchzogen sind und so einzelne Zellen ergeben. Das äußere orange Band mit leuchtend orangen Punkten.
Ähnliche Arten: Der Wachtelweizen-Scheckenfalter, Nickerl`s Scheckenfalter (Melitaea aurelia) und Assmann`s Scheckenfalter (Melitaea britomartis) sind nur durch mikroskopische Untersuchungen voneinander zu unterscheiden.
Von diesen sind der Wegerich-Scheckenfalter (Melitaea cinxia), Flockenblumen-Scheckenfalter (Melitaea phoebe) und der Rote Scheckenfalter (Melitaea didyma) auf der Unterseite der Hinterflügel durch das Vorhandensein schwarzer Punkte in den Zellen der basalen und mittleren weißen Bänder unterscheidbar. Der Baldrian-Scheckenfalter (Melitaea diamina) besitzt auf der Unterseite der Hinterflügel im äußeren orangen Band anstatt der leuchtend orangen Punkte kleine schwarze Punkte.
Gesetzlicher Schutz und Rote Liste
Rote Liste Sachsen: stark gefährdet
Rote Liste Deutschland: gefährdet
Rote Liste Deutschland: vom Aussterben bedroht
Nomenklatur
- Papilio athalia (Rottemburg, 1775)
- Melitaea athalia celadussa Fruhstorfer, 1910 (siehe Wiemers et al. 2018; Tahami et al. 2021)
- Melitaea neglecta Pfau, 1962 (siehe Kurze et al. 2009)
- Melitaea athalia parthenoides Keferstein, 1851 (siehe Wiemers et al. 2018)
Merkmale
M. athalia erreicht Flügelspannweiten von 33–42 mm und Körperlängen zwischen 15–20 mm.
Die Flügelzeichnung eignet sich nicht, M. athalia von Melitaea aurelia und Melitaea britomartis zu unterscheiden. Ungeachtet dessen können die Falter einer Population in ihrer Musterung stark voneinander abweichen (Urbahn 1952). Tendenziell zeigt M. athalia blasse hellgelbe Flecken am Außenrand der Vorderflügelunterseite, die nach innen deutlich schwarz begrenzt sind und der Hinterleib ist auf der Unterseite hellgelb mit grauer Einmischung beschuppt (Urbahn 1952). Individuen, die eine dunklere Postdiskalbinde als die nach außen (marginal) angrenzenden Bereiche aufweisen sollten mikroskopisch auf eine mögliche Artzugehörigkeit zu Melitaea britomartis untersucht werden. Weitere Unterscheidungsmerkmale zwischen diesen Arten liefert der Bestimmungsschlüssel zur Gattung Melitaea.
Das männliche Kopulationsorgan von M. athalia besitzt lange schmale Uncusfortsätze sowie zwei oder drei ausgeprägte Spitzen am Processus posteriores (Kurze et al. 2009).
Die Larven besitzen eine schwarze Grundfarbe auf der sich weiße Flecken und gelbe Scheindornen mit weißer Spitze befinden (Urbahn 1952). Bis zu Verpuppung als schwarz weiße Stürzpuppe erreichen die Larven eine Körperlänge von maximal 25 mm.
Verbreitung
Von Irland, Großbritannien und dem nördlichen Skandinavien südlich bis zur Iberischen Halbinsel, Italien, Griechenland und der Türkei, östlich bis nach Japan; keine Vorkommen auf den Mittelmeerinseln (Nuß 1998; GBIF). In Westeuropa, einschließlich Westdeutschland die Unterart Melitaea athalia parthenoides, in Südeuropa M. a. celadussa.
In Sachsen besitzt die Art mit Populationen auf den mageren Sandböden der Heidelandschaften in Nordostsachen sowie auf den Bergwiesen und Mooren des Vogtlandes und Westerzgebirges zwei Verbreitungsschwerpunkte (Reinhardt et al. 2007).
Lebensweise
In Sachsen bildet M. athalia eine Generation, deren Falter von Mitte Juni bis Anfang August fliegen (Reinhardt et al. 2007). Zu den Nahrungspflanzen der Falter gehören unter anderem Sumpf-Kratzdistel (Cirsium palustre), Flockenblume (Centaurea spec.), Dost (Origanum vulgare), Gewöhnliche Schafgarbe (Achillea millefolium) und Wiesen-Bärenklau (Heracleum sphondylium) (Ebert & Rennwald 1993).
Die Weibchen legen die Eier in Gelegen von mindestens 80 Eiern an die Nahrungspflanzen der Larven ab, wozu in Sachsen Ehrenpreis (Veronica sp.), Wegerich (Plantago sp.), Fingerhut (Digitalis sp.), Wachtelweizen (Melampyrum sp.), Klappertopf (Rhinanthus sp.) und Augentrost (Euphrasia sp.) dienen (Kurze & Kurze 2009). Vor der Überwinterung leben die Larven gesellig. Im Frühjahr vereinzeln sie sich und können in den Nachmittagsstunden fressend an den Futterpflanzen beobachtet werden. Einige Larven überwintern ein zweites Mal (Kurze & Kurze 2009).
Besonders auffällig ist die zeitliche Variabilität des Lebenszyklus von M. athalia. So konnten Kurze & Kurze (2009) keinen Zusammenhang zwischen der Abfolge der Gelege und dem Schlupfzeitraum der Larven erkennen und die Entwicklung der Tiere eines Geleges verlief so verschieden, dass junge Larven, erwachsene Larven und Puppen nebeneinander beobachtet wurden.
Lebensräume
Der Lebensraum von M. athalia ist sehr variabel, wobei die Verzahnung zwischen mageren Offenlandbiotopen mit Waldrändern oder Gebüschen eine bedeutende Rolle spielt (Reinhardt et al. 2007). Ebert & Rennwald (1993) nennen folgende Biotope: Halbtrockenrasen an buschreichen Hängen auf Kalkstandorten, Wege und Waldränder, aufgelassene Weinberge und Steinbrüche, Silikat-Magerrasen sowie Feuchtwiesen am Rand von Mooren und Streuwiesen in Niedermoorbereichen. Darüber hinaus treten die Falter ebenfalls häufig im mesophilen Bereich wie beispielsweise in trockenen und feuchten Glatthaferwiesen, auf Lichtungen sowie an Rändern und Wegen von Laubmischwäldern auf (Ebert & Rennwald 1993). Diese Angaben gelten ebenfalls für Sachsen (vgl. Reinhardt et al. 2007). Eine große Bedeutung besitzen an allen Standorten Randstrukturen wie blütenreiche Saumgesellschaften (Ebert & Rennwald 1993).
Bestandssituation
M. athalia war um 1900 in Sachsen noch überall häufig (Möbius 1905). Bereits 1917 prognostizierte Lenz, dass sich die Art auf den Mähwiesen nicht halten können wird, weil die Larven dort ab Juli bis zum Frühjahr gesellig in Nestern leben. Damals wies ein solches Nest Hunderte Larven auf! Im Verlauf des 20. Jahrhunderts ist M. athalia in Sachsen durch die intensive Wiesennutzung, bei der die Nester zerstört werden, stark zurückgegangen, aber in einigen lichten Kiefernwäldern gegenwärtig noch in individuenreichen Populationen anzutreffen (Kurze & Kurze 2009).
Nachteilig für M. athalia wirkt sich neben der Mahd von Waldwiesen oder Lichtungen ebenfalls die Pflege von Waldrändern, der Einsatz von Herbiziden an Heckensäumen, Wald- und Wegrändern sowie die Reduzierung der wichtigen Übergangsbereiche zwischen Wald- und Feldflur aus, weil dadurch die blütenreichen Saumgesellschaften mit den Nahrungspflanzen der Larven zu mindestens zeitweilig verloren gehen (Ebert & Rennwald 1993; Settele et al. 2009).
In Sachsen hat diese am weitesten verbreitete Scheckenfalterart erhebliche Populations- und Flächenverluste erlitten (Reinhardt et al. 2007).
Literatur
- Batori, E., K. Pecsenye, J. P. Toth, & Z. Varga 2012: Patterns of genetic and morphometric differentiation in Melitaea (Mellicta) athalia (Lepidoptera: Nymphalidae). – Biological Journal of the Linnean Society 107 (2): 398–413.
- Dietrich, W. 2014: Saugmedien von Polyommatus amandus (Schneider, 1792) und Melitaea athalia (Rottemburg, 1775) und Bemerkungen zur Bestandssituation (Lepidoptera). – Entomologische Nachrichten und Berichte 58 (102): 88–90.
- Ebert, G. 1991: Die Schmetterlinge Baden-Württembergs. Band 1, Tagfalter I. – Verlag Eugen Ulmer, Stuttgart. 552 S.
- Eliasson, C. U. & M. R. Shaw 2003: Prolonged life cycles, oviposition sites, foodplants and Cotesia parasitoids of Melitaeini butterflies in Sweden. – Oedippus 21: 1–52.
- Kudrna, O. 1995: On the identity and status of Melitaea neglecta Pfau, 1962. – Entomologist´s Gazette 46: 125–129.
- Kurze, S. & B.-J. Kurze 2009: Zur Lebensweise des Wachtelweizen-Scheckenfalters Melitaea athalia (Rottemburg, 1775) (Lepidoptera: Nymphalidae). – Sächsische Entomologische Zeitschrift 4: 33–46.
- Kurze, S., B.-J. Kurze & M. Nuss 2009: Artabgrenzung beim Wachtelweizen-Scheckenfalter Melitaea athalia (Rottemburg, 1775) (Insecta: Lepidoptera). – Märkische Entomologische Nachrichten 11 (1): 25–46, 7 Taf.
- Jugovic, J. & T. Koren 2014: Wing pattern morphology of three closely related Melitaea (Lepidoptera, Nymphalidae) species reveals highly inaccurate external morphology-based species identification. – Nota lepidopterologica 37 (1): 75–90.
- Lenz, F. 1917: Über die Melitaeen der Umgegend Münchens, ihre Raupen und ihre Puppen. – Mitteilungen der Münchner Entomologischen Gesellschaft 8: 26–39.
- Möbius, E. T. A. 1905: Die Grossschmetterlings-Fauna des Königreiches Sachsen. – Deutsche entomologische Zeitschrift Iris, Dresden 18 (1): i–xxi, [i]–[xi], 1–235, Taf 1–2.
- Nuß, M. 1998: Deutsche Übersetzung und fachliche Überarbeitung. – T. Tolman & R. Lewington, Die Tagfalter Europas und Nordwestafrikas. – Franckh-Kosmos Verlags-GmbH & Co., Stuttgart. 319 S.
- Reinhardt, R., Sbieschne, H., Settele, J., Fischer, U. & G. Fiedler 2007: Tagfalter von Sachsen. In: Klausnitzer, B. & R. Reinhardt (Hrsg.): Beiträge zur Insektenfauna Sachsens. – Entomologische Nachrichten und Berichte, Beiheft 11, Dresden. 695 S.
- Settele, J., Steiner, R., Reinhardt, R., Feldmann, R. & G. Hermann (Hrsg.) 2009: Schmetterlinge. Die Tagfalter Deutschlands. 2. Aufl. – Ulmer, Stuttgart. 256 S.
- Tahami, M. S., V. Dinca, K. M. Lee, R. Vila, M. Joshi, M. Heikkilä, L. Dapporto, S. Schmid, P. Huemer & M. Mutanen 2021: Genomics Reveal Admixture and Unexpected Patterns of Diversity in a Parapatric Pair of Butterflies. – Genes 12: 2009.
- Urbahn, E. 1952: Die Unterschiede der Jugendstände und Falter von Melitaea athalia Rott., britomartis Assm. und parthenie Bkh. = aurelia Nick. in Deutschland (Lep.). – Zeitschrift der Wiener entomologischen Gesellschaft 37 (63) (7/8): 105-121, Taf. 12-15.
- Weidemann, H.-J. 1988: Tagfalter Bd.1+2. – Verlag J. Neumann-Neudamm GmbH & Co. KG., Melsungen.
- Wiemers, M., E. Balletto, V. Dincă, Z. F. Fric, G. Lamas, V. Lukhtanov, M. L. Munguira, C. A. M. van Swaay, R. Vila, A. Vliegenthart, N. Wahlberg & R. Verovnik 2018: An updated checklist of the European Butterflies (Lepidoptera, Papilionoidea). – ZooKeys 811: 9–45.
Links
Autor(-en): Susanne Kurze, Matthias Nuß. Letzte Änderung am 22.12.2021
|

Männlicher Falter von Melitaea athalia, Flügeloberseite
(© Susanne Kurze)
Männlicher Falter von Melitaea athalia, Flügeloberseite (© Susanne Kurze)( Bild vergrößern)

Männlicher Falter von Melitaea athalia, Flügelunterseite
(© Susanne Kurze)
Männlicher Falter von Melitaea athalia, Flügelunterseite (© Susanne Kurze)( Bild vergrößern)

Mehrere Wachtelweizenscheckenfalter tummeln sich auf einem Blütenstand des Jakobskreuzkrautes. Juli 2014, nordwestlich Bärwalde
(© Matthias Nuß)
Mehrere Wachtelweizenscheckenfalter tummeln sich auf einem Blütenstand des Jakobskreuzkrautes. Juli 2014, nordwestlich Bärwalde (© Matthias Nuß)( Bild vergrößern)
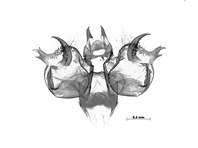
Männlicher Genitalapparat eines Falters aus Medingen (prep. Susanne Kurze)
(© Susanne Kurze)
Männlicher Genitalapparat eines Falters aus Medingen (prep. Susanne Kurze) (© Susanne Kurze)( Bild vergrößern)

Eispiegel vom Wachtelweizenscheckenfalter abgelegt an Wachtelweizen am 16.7.2013 in Alt-Zauche im Spreewald.
(© Matthias Hartung)
Eispiegel vom Wachtelweizenscheckenfalter abgelegt an Wachtelweizen am 16.7.2013 in Alt-Zauche im Spreewald. (© Matthias Hartung)( Bild vergrößern)

Erwachsene Larve von Melitaea athalia auf Wegerich ( Plantago)
(© Susanne Kurze)
Erwachsene Larve von Melitaea athalia auf Wegerich ( Plantago) (© Susanne Kurze)( Bild vergrößern)

Puppen von Melitaea athalia aus Medingen, 04.06.2008
(© Susanne Kurze)
Puppen von Melitaea athalia aus Medingen, 04.06.2008 (© Susanne Kurze)( Bild vergrößern)
|