Diagnose
Vorderflügellänge 18–22 mm.
Flügeloberseiten orange mit schwarzen Adern sowie schwarzen Flecken, die zu Bändern verschmolzen sind (Gitterzeichnung). Vor dem Ende der Hinterflügel schwarze Punkte in den Zellen. Außenrand schwarz, Fransen schwarz-weiß gescheckt.
Flügelunterseiten: Vorderflügel orange mit schwarzen Flecken. Hinterflügel mit fünf abwechselnd gelblich-weißen und orangen Bändern, die seitlich von schwarzen Linien und längs von schwarzen Adern durchzogen sind und so einzelne Zellen ergeben. In den Zellen des äußeren orangen Bandes leuchtend orange Punkte, die meist einen kleineren schwarzen Punkt enthalten. In den gelblich-weißen Zellen schwarze Punkte bzw. Striche.
Ähnliche Arten: Bei Melitaea phoebe und Melitaea didyma der Hinterflügel oberseits am Ende ohne schwarze Punkte in den Zellen sowie unterseits die Zellen des oranges Bandes ohne schwarze Punkte bzw. zu einem durchgehenden orangen Band verschmolzen.
Gesetzlicher Schutz und Rote Liste
Rote Liste Sachsen: stark gefährdet
Rote Liste Deutschland: gefährdet
Merkmale
Falter
Flügelspannweite: 36–42 mm.
Kopf: Palpen (Lippentaster) mit einer gelblich orangen Färbung; Fühlersegmente deutlich weiß voneinander abgesetzt.
Thorax: Auf der Unterseite der Vorderflügel hebt sich die gelblich weiße mit schwarzen Zeichnungselementen durchsetzte Spitze des Flügels von der restlichen orange gefärbten Fläche ab. In den eckigen Feldern der Postdiskalbinde der Hinterflügelunterseite wiederholen sich die schwarzen Flecken der Oberseite auf orangen Grund. Außerdem wird die Postdiskalbinde auf dieser Flügelseite von außen und innen durch schwarze konkave Linien begrenzt. Am Rand der Hinterfügelunterseite besitzen die Falter in der hellgelben Submarginalbinde dreiecksförmige Zeichnungselemente, zwischen denen keine Verbindung besteht.
Geschlechtsdimorphismus: Auf der Flügeloberseite besitzen die Weibchen eine ausgedehnte dunkle Zeichnung auf einer helleren orangenen Grundfarbe. Bei den Männchen fallen die schwarzen Linien wesentlich dünner aus.
Hinterleib: Das männliche Kopulationsorgan mit einem deutlich hakenförmig nach außen gebogenen Processus posteriores, an welchem sich im peripheren Bereich weitere kurze Zähne befinden können.
Larve
Die ausgewachsenen Larven sind etwa 2,5 mm lang, besitzen eine schwarze Grundfarbe mit silbergrauen Querbinden, schwarzgrauen Scheindornen und eine rötlich-braun gefärbte Kopfkapsel (Weidemann 1988; Settele et al. 2009).
Puppe
Graubraune Stürzpuppe.
Verbreitung
Das Verbreitungsgebiet von M. cinxia erstreckt sich von Nordafrika bis Südengland und das südliche Fennoskandien sowie bis nach Ostasien. Innerhalb des Areals können genetisch vier geographische Linien unterschieden werden: (1) Marokko, (2) Iberische Halbinsel, Frankreich, Italien, (3) Mittel- und Nordwesteuropa, Balkan, Griechenland, Anatolien, Levante sowie (4) Osteuropa, Iran, Sibirien und China (Wahlberg & Saccheri 2007). Nach Roux et al. (2016) sind die Populationen in Marokko von denen in Europa genetisch getrennt, so dass es sich hier um kryptische Arten handelt.
Lebensweise
In Deutschland bildet M. cinxia eine Generation, deren Falter von Anfang Juni bis Ende Juli fliegen (Settele et al. 2009; Weidemann 1988). Nur in einigen Regionen Südwesteuropas tritt die Art in zwei Generationen auf (Nieminen et al. 2004). Bisher sind die Nektarpflanzen von M. cinxia nur unzureichend erfasst (Ebert & Rennwald 1993). Einzelne Beobachtungen von Nahrungsaufnahmen stammen von Habichtskraut (Hieracium sp.), Acker-Witwenblume (Knautia arvensis), Thymian (Thymus sp.), Ehrenpreis (Veronica sp.), Rot-Klee (Trifolium pratense) und Hahnenfuß (Ranunculus sp.) (Ebert & Rennwald 1993; Settele et al. 2009).
Die Eiablage erfolgt in Gelegen von 100 bis 200 Eiern, in der Regel an der Blattunterseite der Larvennahrungspflanze, nah an der Bodenoberfläche (Nieminen et al. 2004). Nach etwa drei Wochen schlüpfen die Larven und leben besonders bei Nacht und schlechtem Wetter in einem Gespinst an der Wirtspflanze, in dem sie ebenfalls gesellig überwintern (Nieminen et al. 2004). Über diese Gespinste lässt sich M. cinxia gut nachweisen. Nach dem Winter vereinzeln sich die Larven (Weidemann 1988; Reinhardt et al. 2007; Settele et al. 2009).
Als Nahrungspflanzen nutzen die Larven in Sandgebieten, Mooren und anderen Feuchtgebieten insbesondere Spitzwegerich (Plantago lanceolata), auf kalkhaltigen Böden überwiegend Mittleren Wegerich (Plantago media) und Großen Ehrenpreis (Veronica teucrium). Weitere bekannte Nahrungspflanzen der Larven sind Gamander-Ehrenpreis (Veronica chamaedrys), Mehlige Königskerze (Verbascum lychnitis), Wiesen-Salbei (Salvia pratensis), Skabiosen-Flockenblume (Centaure scabiosa) und Kleines Habichtskraut (Hieracium pilosella) (Weidemann 1988; Ebert & Rennwald 1993; Reinhardt et al. 2007; Bräu et al. 2013).
Die Verpuppung erfolgt an Grasbüscheln (Weidemann 1988; Nieminen et al. 2004).
Lebensräume
Zu den Lebensräumen von M. cinxia gehören sowohl trockene als auch feuchte Magerstandorte, wobei die meisten Populationen heute auf trockenen Standorten vorkommen (Ebert & Rennwald 1993; Reinhardt et al. 2007; Bräu et al. 2013). In Sachsen besiedelt die Art überwiegend magere Offenlandlebensräume wie Sandmagerrasen oder nährstoffarme (submontane) Frischwiesen (Reinhardt et al. 2007). Alternativ nutzt M. cinxia besonnte Grastreifen entlang von Waldrändern, Waldwiesen oder Schlagfluren (Ebert & Rennwald 1993; Settele et al. 2009). Als Lebensräume mit einer höheren Feuchte gelten Streuwiesen und Flachmoorwiesen (Ebert & Rennwald 1993). Besonders für die wärmebedürftigen Larven besitzt die ausreichende Besonnung der Entwicklungshabitate mit geringwüchsiger und lückiger Vegetation eine hohe Bedeutung (Ebert & Rennwald 1993; Reinhardt et al. 2007).
Bestandssituation
Nutzungsaufgabe oder Intensivierung führten in den letzten Jahrzehnten zu einer stetigen Abnahme von Magerrasenhabitaten, wodurch geeignete Lebensräume für M. cinxia europaweit verschwinden (Nieminen et al. 2004; Settele et al. 2009). In Sachsen setzte der negative Bestandstrend des Wegerich-Scheckenfalters bereits im 19. Jahrhundert ein (Reinhardt et al. 2007). Hier kommt die Art heute hauptsächlich in den nördlichen Sandgebieten vor.
Für die Erhaltung des Wegerich-Scheckenfalters empfehlen Reinhardt et al. (2007) stets eine partielle Mahd, wobei zur Zeit der Raupennester diese zuvor markiert und bei der Mahd ausgelassen werden sollen bzw. die tiefliegenden Winternester durch ein entsprechend hoch eingestelltes Mahdwerkzeug verschont bleiben. Bei einem Mahdtermin kurz vor oder während der Flugzeit der Falter müssen durch eine partielle Mahd ausreichend Nektarpflanzen belassen werden. Bräu et al. (2013: 406) empfehlen eine einschürige Mahd zwischen Mitte Juli und Mitte September, mit Aussparung jährlich wechselnder Teilflächen oder eine extensive Beweidung (keine Standkoppel).
Wissenschaftliche Erforschung
In Finnland wurden Ökologie und Genetik des Wegerich-Scheckenfalters intensiv unter dem Biologen Ilkka Hanski (1953–2016) untersucht. Von 1991 bis 2012 erfolgten auf den Åland Islands in einem Gebiet von 50 × 70 km mit 4.000 Habitatpatches Langzeituntersuchungen, an denen 361 Feldassistent*innen teilnahmen. Eingehend wurden Paarungsverhalten, Eiablage, Wirtspflanzenpräferenzen, Ausbreitungsverhalten, Lebensweise und Verhalten der Larven, Inzucht und daraus folgende demographische Konsequenzen, der Einfluss genetischer Eigenschaften auf die Lebensweise, lokale Populationsdynamik, genetische Ursachen der Populationsdynamik, Metapopulationsdynamik u. a. m. untersucht (vergleiche Ojanen et al. 2013). Damit gehört der Wegerich-Scheckenfalter zu den am besten erforschten Tagfalterarten Europas.
Mit seinen Forschungen lieferte Hanski einen wichtigen Beitrag zur Entwicklung der Metapopulationstheorie. Diese befasst sich mit den dynamischen Folgen der Migration lokaler Populationen und der regionalen Beständigkeit von Arten mit instabilen lokalen Populationen. Aus den Einflüssen des Habitat-Patch-Gebietes und der Isolation auf Migration, Besiedlung und Aussterben der Population wurden Modelle entwickelt, mit denen Bewegungsmuster von Individuen, die Dynamik der Arten und die Verteilungsmuster in Mehrartengemeinschaften in realen fragmentierten Landschaften vorhergesagt werden können (Hanski 1994, 1998, 1999, 2011; Hanski & Gilpin 1991; Hanski & Gyllenberg 1997; Ovaskainen & Saastamoinen 2018).
Literatur
- Ahola, V., N. Wahlberg & M. J. Frilander 2017: Butterfly genomics: insights from the genome of Melitaea cinxia. – Annales Zoologici Fennici 54: 275–291.
- Bräu, M., R. Bolz, H. Kolbeck, A. Nunner, J. Voith & W. Wolf 2013: Tagfalter in Bayern. – Eugen Ulmer, Stuttgart. 781 S.
- Ebert, G. & E. Rennwald 1993: Die Schmetterlinge Baden-Württembergs. Band 1: Tagfalter 1. – Eugen Ulmer, Stuttgart. 552 S.
- Hanski, I. 1994: A practical model of metapopulation Dynamics. – The Journal of Animal Ecology 63 (1): 151-162.
- Hanski, I. 1998: Metapopulation Dynamics. – Nature 396: 41–49.
- Hanski, I. 1999. Metapopulation ecology. – Oxford Univ. Press, New York, NY.
- Hanski, I. 2011. Eco‐evolutionary spatial dynamics in the Glanville fritillary butterfly. – Proceedings of the National Acadademy of Sciences USA 108:14397–14404.
- Hanski, I. & M. Gilpin 1991: Metapopulation dynamics: brief history and conceptual domain. – Biological Journal of the Linnean Society 42 (1–2): 3–16.
- Hanski, I. & M. Gyllenberg 1997: Uniting two general patterns in the distribution of species. – Science 275: 397–400.
- Hanski, I., M. Kuussaari & M. Nieminen 1994: Metapopulation sructure and migration in the butterfly Melitaea cinxia. – Ecology 75:747–762.
- Kuussaari, M., M. Nieminen & I. Hanski 1996: An experimental study of migration in the Glanville fritillary butterfly Melitaea cinxia. – Journal of Animal Ecology 65 (6): 791–801.
- Lenz, F. 1917: Über die Melitaeen der Umgegend Münchens, ihre Raupen und ihre Puppen. – Mitteilungen der Münchner Entomologischen Gesellschaft 8: 26–39.
- Nieminen, M., Siljander, M. & I. Hanski 2004: Structure and dynamics of Melitaea cinxia metapopulations. – In: P. R. Ehrlich & I. Hanski, On the wings of checkerspots: a Model system for population biology. – Oxford University Press, Oxford: 63–91.
- Niitepõld, K. & M. Saastamoinen 2018: A candidate gene in an ecological model species: Phosphoglucose isomerase (Pgi) in the Glanville fritillary butterfly (Melitaea cinxia). – Annales Zoologici Fennici 54: 259–273.
- Ojanen, S. P., M. Nieminen, E. Meyke, J. Pöyry & I. Hanski 2013: Long‐term metapopulation study of the Glanville fritillary butterfly (Melitaea cinxia): survey methods, data management, and long‐term population trends. – Ecology and Evolution 3 (11): 3713–3737.
- Ovaskainen, O. & M. Saastamoinen 2018: Frontiers in Metapopulation Biology: The Legacy of Ilkka Hanski. – Annual Review of Ecology, Evolution, and Systematics 49: 231–252.
- Reinhardt, R., Sbieschne, H., Settele, J., Fischer, U. & G. Fiedler 2007: Tagfalter von Sachsen. In: Klausnitzer, B. & R. Reinhardt (Hrsg.): Beiträge zur Insektenfauna Sachsens. – Entomologische Nachrichten und Berichte, Beiheft 11, Dresden. 695 S.
- Roux, C., C. Fraïsse, J. Romiguier, Y. Anciaux, N. Galtier & N. Bierne 2016: Shedding light on the grey zone of speciation along a continuum of genomic divergence. – PLOS Biology 14 (12): e2000234.
- Settele, J., R. Feldmann & R. Reinhardt 1999: Die Tagfalter Deutschlands. – Eugen Ulmer, Stuttgart. 452 S.
- Settele, J., Steiner, R., Reinhardt, R., Feldmann, R. & G. Hermann (Hrsg.) 2009: Schmetterlinge. Die Tagfalter Deutschlands. 2. Aufl. – Ulmer, Stuttgart. 256 S.
- Wahlberg, N. & I. Saccheri 2007: The effects of Pleistocene glaciations on the phylogeography of Melitaea cinxia (Lepidoptera: Nymphalidae). – European Journal of Entomology 104 (4): 675–684.
- Weidemann, H.-J. 1988: Tagfalter. Band 2 Biologie - Ökologie - Biotopschutz. – Neumann-Neudamm, Melsungen. 372 S.
Links
Autor(-en): Susanne Kurze, Matthias Nuß. Letzte Änderung am 24.02.2019
|

am 19.05.2012 suchten mehr als 6 Wegerich-Scheckenfalter in Dauban, Oberlausitz, auf einer Wiese einen Schlafplatz
(© Eva-Maria Bäßler)
am 19.05.2012 suchten mehr als 6 Wegerich-Scheckenfalter in Dauban, Oberlausitz, auf einer Wiese einen Schlafplatz (© Eva-Maria Bäßler)( Bild vergrößern)

am 19.05.2012 suchten mehr als 6 Wegerich-Scheckenfalter in Dauban, Oberlausitz, auf einer Wiese einen Schlafplatz
(© Eva-Maria Bäßler)
am 19.05.2012 suchten mehr als 6 Wegerich-Scheckenfalter in Dauban, Oberlausitz, auf einer Wiese einen Schlafplatz (© Eva-Maria Bäßler)( Bild vergrößern)
.jpeg)
Wegerich-Scheckenfalter, Tagfund 28.05.2017, Schwarzkollm Koselbruch
(© Martina Görner)
Wegerich-Scheckenfalter, Tagfund 28.05.2017, Schwarzkollm Koselbruch (© Martina Görner)( Bild vergrößern)

Wegerich-Scheckenfalter am 22.05.2011 auf einem Lagerplatz für Erdstoffe und Bio-Abfälle am Rande des Tharandter Waldes
(© Lothar Brümmer)
Wegerich-Scheckenfalter am 22.05.2011 auf einem Lagerplatz für Erdstoffe und Bio-Abfälle am Rande des Tharandter Waldes (© Lothar Brümmer)( Bild vergrößern)

Wegerich-Scheckenfalter am 22.05.2011 auf einem Lagerplatz für Erdstoffe und Bio-Abfälle am Rande des Tharandter Waldes
(© Lothar Brümmer)
Wegerich-Scheckenfalter am 22.05.2011 auf einem Lagerplatz für Erdstoffe und Bio-Abfälle am Rande des Tharandter Waldes (© Lothar Brümmer)( Bild vergrößern)

Melitaea cinxia im Mai 2015 an der Schwarzen Elster bei Plessa (Aufgenommen mit der Canon 6D)
(© Daniel Kopsch)
Melitaea cinxia im Mai 2015 an der Schwarzen Elster bei Plessa (Aufgenommen mit der Canon 6D) (© Daniel Kopsch)( Bild vergrößern)

Wegerich-Scheckenfalter am 14.05.2015 in Dauban
(© Eva-Maria Bäßler)
Wegerich-Scheckenfalter am 14.05.2015 in Dauban (© Eva-Maria Bäßler)( Bild vergrößern)

Larve des Wegerich-Scheckenfalters am 26.04.2014 in Dauban
(© Eva-Maria Bäßler)
Larve des Wegerich-Scheckenfalters am 26.04.2014 in Dauban (© Eva-Maria Bäßler)( Bild vergrößern)
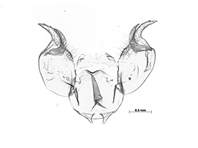
Männliches Kopulationsorgan von Melitaea cinxia, Korcina, Bosnien, MTD (prep. S. Kurze)
(© Susanne Kurze)
Männliches Kopulationsorgan von Melitaea cinxia, Korcina, Bosnien, MTD (prep. S. Kurze) (© Susanne Kurze)( Bild vergrößern)
|