Diagnose
Männchen: Schuppendecke länglich, weiß oder hellgrau, mit terminalen gelben Exuvien. Ausgewachsenes Männchen flügellos, mit orangegelbem Körper.
Weibchen: Schuppendecke des Weibchens rund, flach oder leicht konvex, 0,75–1,6 mm im Durchmesser, normalerweise weiß oder hellgrau oder weißlich-gelb, mit gelben oder braunen zentralen oder subzentralen Der Körper des Weibchens ist hellrosa bis orangegelb, wird mit zunehmendem Alter dunkelrotbraun.
Gesetzlicher Schutz und Rote Liste
—
Nomenklatur
Diese Art wurde vielfach verkannt, sei es durch Fehlbestimmungen oder die Nutzung falscher Namen. Erst Lindinger (1911) erkannte diese Problematik und stellte den von Signoret (1869) etablierten Namen Diaspis leperii in der Gattungskombination ‚Epidiaspis leperei‘ wieder her.
Merkmale
Verbreitung
Epidiaspis leperii kommt von der südlichen Ostseeküste bis Nordafrika vor und wurde weltweit verschleppt, fehlt aber u.a. in Großbritannien, Australien und auf den pazifischen Inseln (PESI; Diaspididae of the World 2.0).
Lebensweise
Epidiaspis leperii lebt an den verholzten Teilen von Rosaceae, insbesondere Kulturapfel (Malus domestica), Kultur-Birne (Pyrus communis) und Kulturpflaume (Prunus domestica), wird aber auch auf anderen Laubbäumen gefunden, so Echte Walnuss (Juglans regia) (Juglandaceae) und Gewöhnliche Rosskastanie (Aesculus hippocastanum) (Schmutterer 1959).
Die Schildläuse leben auf Zweigen, Ästen und an Stämmen. Die Fortpflanzung erfolgt sexuell, die befruchteten Weibchen überwintern. Es entwickelt sich eine Generation pro Jahr. Im April und Mai legen die Weibchen 40–50 Eier pro Tier ab. Die Jungtiere siedeln sich oft in der Nähe der weiblichen Schuppen an, wodurch sich bei länger anhaltender und individuenreicher Besiedlung mehrere Schichten von Schuppen übereinander bilden können. Im August sind die Tiere ausgewachsen (Schmutterer 1959; Gill 1997).
Natürliche Gegenspieler sind der Häufigkeit nach Erzwespen der Gattung Aphytis und Thomsonisca amathus, gefolgt von den räuberischen Gallmücken Lestodiplosis diaspidis und Dentifibula viburni sowie für die wandernden L1-Larven Rundfleckiger Schildlaus-Marienkäfer (Chilocorus renipustulatus), Strichfleckiger Schildlaus-Marienkäfer (Chilocorus bipustulatus) und der Schildlauskäfer Cybocephalus politus (Harzer et al. 2018; Hudelist & Samuel 2021; Lutsch & Zimmermann 2022).
Lebensräume
Parks, Gärten, Streuobstwiesen, Obstplantagen.
Bestandssituation und wirtschaftliche Bedeutung
Noch 1959 schreibt Schmutterer, dass die Art in Deutschland vor allem in wärmeren Gebieten im Westen und Südwesten, z. B. im Rhein-Main- und Rhein-Neckar-Gebiet sowie in der Pfalz vorkommt, während sie in kühleren Gebieten meist nur örtlich auftritt. Schmutterer (2003) war diese Art für Schleswig-Holstein, Niedersachsen, Mecklenburg-Vorpommern, Sachsen-Anhalt, Brandenburg, Thüringen und Sachsen noch nicht bekannt.
In Brandenburg wurden 2019 mehrere bereits etablierte Kolonien von E. leperii an Birnen in Plötzin und Glindow (Havelobstanbaugebiet) nachgewiesen (Schrader et al. 2022).
In Sachsen wurde E. leperii im Jahr 2021 in Einzelexemplaren in Dresden-Langebrück an einem Ast von Kulturapfel (Malus domestica) und an einem Stamm von Kulturpflaume (Prunus domestica) sowie in Radebeul an Zweigen von Chinesischer Wildbirne (Pyrus calleryana) nachgewiesen (Köhler et al. 2021). Weitere Einzelnachweise finden sich bei Schmidt et al. (2024). 2025 weist Thomas Lochschmidt auf einen starken Befall an den Stämmen von Apfel, Birne und Pflaume auf einer Streuobstwiese in Dresden hin (siehe Fotos rechts von Matthias Nuß).
Epidiaspis leperii verursacht Saugschäden an Stämmen von Birnen, Äpfeln, Pflaumen und Kirschen, was insbesondere an jungen Bäumen schwere Schäden hervorrufen kann (Kozár & Viktorin 1978; Kosztarab & Kozár et al. 1979; Kozár 1988; Gill 1997). In Kalifornien ist die Schildlaus nicht besonders schädlich, außer für Walnussbäume mit starkem Flechtenbewuchs, wo große Populationen die Bäume schwächen sowie Nussgröße und -ertrag verringern (Gill, 1997). In Griechenland, Spanien, Algerien, Marokko, der Türkei und Italien verursacht diese Schildlaus zum Teil schwere Schäden an Olivenbäumen (Argyriou 1990).
Literatur
- Argyriou, L. C. 1990: Olive. S. 579–583. – In: D. Rosen, Armoured scale insects, their biology, natural enemies and control. – World Crop Pests, Vol. 4B. – Elsevier, Amsterdam.
- Gill, R. J. 1997: The scale insects of California. Part 3. The armored scales (Homoptera: Coccoidea: Coccidae). – Technical Series in Agricultural Biosystematics and Plant Pathology No. 3. California Department of Food and Agriculture, Sacramento, California, USA. 307 S.
- Harzer, U., W. Dahlbender, J. Sauter, K. Köppler, H. Rauleder, O. Zimmermann & S. Frey 2018: Die Rote Austernförmige Schildlaus am Oberrhein – Leitfaden zur Bedeutung, Verbreitung, Biologie, Erfassung und Monitoring sowie Bekämpfung. – LTZ Augustenberg, DLR Rheinpfalz und FREDON Alsace. 12 S.
- Hudelist, P. & N. Samuel 2021: Die Rote Austernförmige Schildlaus – ein neuer Schaderreger „under cover“. – Öko-Obstbau 4 | 2021: 26–28.
- Köhler, G., K. Reinhardt & C. Schmidt 2021: Freilebende Schildläuse (Coccina) in Sachsen – eine Übersicht. – Entomologische Nachrichten und Berichte 65 (3): 285–309.
- Kozár, F., G. M. Konstantinova, K. Akman, M. Altay & H. Kiroglu 1979: Distribution and density of scale insects (Homoptera: Coccoidea) on fruit plants in Turkey in 1976 (Survey of scale insect (Homoptera: Coccoidea) infestations in European orchards No. 11). – Acta Phytopathologica Academiae Scientiarum Hungaricae 14: 535–542.
- Kozár, F. & R. A. Viktorin 1978: Survey of scale insect (Homoptera: Coccoidea) infestations in European orchards. Changes in the scale infestation levels in Hungarian orchards between 1971 and 1976. – Acta Phytopathologica Academiae Scientiarum Hungaricae 13: 391–402.
- Kosztarab, M. & F. Kozár 1988: Scale insects of Central Europe. – Akademiai Kaido, Budapest, Hungary. 456 S.
- Lindinger, L. 1911: Beiträge zur Kenntnis der Schildläuse und ihrer Verbreitung. II. – Zeitschrift für wissenschaftliche Insektenbiologie 7: 353–358.
- Lutsch, B. & O. Zimmermann 2022: Rote Austernförmige Schildlaus Epidiaspis leperii. – Hinweise zur Pflanzengesundheit. – Landwirtschaftliches Technologiezentrum Augustenberg (LTZ), Karlsruhe. 4 S.
- Schmutterer, H. 1959: Schildläuse oder Coccoidea. I. Deckelschildläuse oder Diaspididae. – In: F. Dahl, Die Tierwelt Deutschlands und der angrenzenden Meeresteile. 45. Teil. – VEB Gustav Fischer Verlag Jena. 260 S., 6 Taf.
- Schmidt, C., T. Sobczyk & K. Reinhardt 2024: Freilebende Schildläuse in Sachsen (Hemiptera, Coccina) – Ergänzungen. – Entomologische Nachrichten und Berichte 68: 113–145.
- Schmutterer, H. 2003: Verzeichnis der Schildläuse (Coccina) Deutschlands. – In: B. Klausnitzer, Entomofauna Germanica. Band 6. – Entomologische Nachrichten und Berichte, Beiheft 7: 194–208.
- Schrader, G., A. Wilstermann, B. Heß, P. Baufeld, C. Fitzner, J. Strassemeyer, A. R. Dominic, T. Waldau, A. de Kock & S. Nordheim 2022: Proaktive pflanzengesundheitliche Risikoanalyse durch Modellierung und Monitoring: Anpassung an langfristige Risiken durch klimasensitive Schadorganismen (ProgRAMM)Teilprojekt 1. Schlussbericht. Julius-Kühn Institut, Bundesforschungsinstitut für Kulturpflanzen, Quedlinburg. 38 S.
Links
Autor(-en): Matthias Nuß. Letzte Änderung am 01.09.2025
|
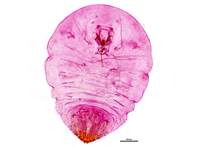
Schildlaus von einem Apfelbaum in Langebrück, Oktober 2023. Foto des präparierten Exemplars. Prep. & det. Christian Schmidt.
(© Matthias Nuß)
Schildlaus von einem Apfelbaum in Langebrück, Oktober 2023. Foto des präparierten Exemplars. Prep. & det. Christian Schmidt. (© Matthias Nuß)( Bild vergrößern)
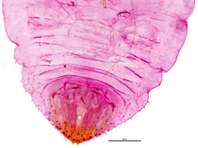
Schildlaus von einem Apfelbaum in Langebrück, Oktober 2023. Foto des präparierten Exemplars. Der Ausschnitt zeigt insbesondere das Abdomenende. Prep. & det. Christian Schmidt.
(© Matthias Nuß)
Schildlaus von einem Apfelbaum in Langebrück, Oktober 2023. Foto des präparierten Exemplars. Der Ausschnitt zeigt insbesondere das Abdomenende. Prep. & det. Christian Schmidt. (© Matthias Nuß)( Bild vergrößern)
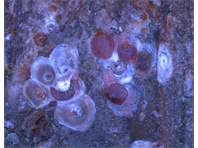
Schilde an einem Zweig eines Straßenbaumes ( Pyrus calleryana). Links die abgenommenen Schilde von unten gesehen, rechts die weiblichen Läuse auf dem Zweig. Radebeul, Juni 2021.
(© Christian Schmidt)
Schilde an einem Zweig eines Straßenbaumes ( Pyrus calleryana). Links die abgenommenen Schilde von unten gesehen, rechts die weiblichen Läuse auf dem Zweig. Radebeul, Juni 2021. (© Christian Schmidt)( Bild vergrößern)
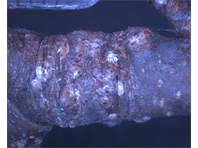
Schilde an einem Zweig eines Straßenbaumes ( Pyrus calleryana). Radebeul, Juni 2021.
(© Christian Schmidt)
Schilde an einem Zweig eines Straßenbaumes ( Pyrus calleryana). Radebeul, Juni 2021. (© Christian Schmidt)( Bild vergrößern)

Starker, mehrschichtiger Befall verursacht großflächige Depression des Apfelstammes. Dresden, Streuobstwiese, Mai 2025.
(© Matthias Nuß)
Starker, mehrschichtiger Befall verursacht großflächige Depression des Apfelstammes. Dresden, Streuobstwiese, Mai 2025. (© Matthias Nuß)( Bild vergrößern)

Starker, mehrschichtiger Befall verursacht großflächige Depression des Apfelstammes. Dresden, Streuobstwiese, Mai 2025.
(© Matthias Nuß)
Starker, mehrschichtiger Befall verursacht großflächige Depression des Apfelstammes. Dresden, Streuobstwiese, Mai 2025. (© Matthias Nuß)( Bild vergrößern)

Starker, mehrschichtiger Befall verursacht großflächige Depression des Apfelstammes. Dresden, Streuobstwiese, Mai 2025.
(© Matthias Nuß)
Starker, mehrschichtiger Befall verursacht großflächige Depression des Apfelstammes. Dresden, Streuobstwiese, Mai 2025. (© Matthias Nuß)( Bild vergrößern)
|